Mendeljejevljev periodni sustav je nov. Mendeljejevljev periodni sustav i periodni zakon.
Tijekom devetnaestog stoljeća mnoga su područja doživjela snažnu reformu, uključujući i kemiju. Periodni sustav elemenata Periodna teorija, formulirana 1869., dovela je do jedinstvenog razumijevanja ovisnosti o položaju jednostavnih tvari u periodnom sustavu, uspostavljajući odnos između relativne atomske mase, valencije i svojstava elementa.
Razdoblje kemije prije Mendeljejeva
Nešto ranije, početkom devetnaestog stoljeća, njemački kemičar Döbereiner izveo je prve ozbiljne radove na području kemije. Utvrdio je da se niz sličnih tvari prema svojim svojstvima može spojiti u skupine – trijade.
Pogreška ideja njemačkog znanstvenika
Bit predstavljenog zakona Döbereinerovih trijada određena je činjenicom da je atomska masa željene tvari blizu poluzbroja (prosječne vrijednosti) atomskih masa posljednja dva elementa trijadne tablice. Međutim, odsutnost magnezija u jednoj podskupini kalcija, stroncija i barija bila je pogrešna.
Ovaj pristup bio je posljedica umjetnog ograničenja sličnih tvari samo na trostruke saveze. Döbereiner je jasno uočio sličnosti u kemijskim parametrima fosfora i arsena, bizmuta i antimona. Međutim, ograničio se na pronalaženje trijada. Kao rezultat toga, nije mogao doći do točne klasifikacije kemijskih elemenata.
Döbereiner svakako nije uspio podijeliti postojeće elemente u trijade; zakon je jasno ukazao na postojanje odnosa između i svojstava jednostavnih kemijskih tvari.
Postupak usustavljivanja kemijskih elemenata
Svi kasniji pokušaji sistematizacije temeljili su se na raspodjeli elemenata ovisno o njihovoj atomskoj masi. Kasnije su Döbereinerovu hipotezu koristili i drugi kemičari. Pojavila se formacija trijada, tetrada i pentada (spajanje u skupine od tri, četiri i pet elemenata).
U drugoj polovici devetnaestog stoljeća istovremeno se pojavilo nekoliko radova, na temelju kojih je Dmitrij Ivanovič Mendeljejev doveo kemiju do potpune sistematizacije kemijskih elemenata. Drugačija struktura Mendeljejevljeva periodnog sustava dovela je do revolucionarnog razumijevanja i očitosti mehanizma raspodjele jednostavnih tvari.
Mendeljejevljev periodni sustav elemenata
Na sastanku ruske kemijske zajednice u proljeće 1869. pročitana je obavijest ruskog znanstvenika D.I. Mendeljejeva o njegovom otkriću periodičnog zakona kemijskih elemenata.  Krajem iste godine objavljeno je prvo djelo “Osnove kemije” koje je uključivalo prvi periodni sustav elemenata.
Krajem iste godine objavljeno je prvo djelo “Osnove kemije” koje je uključivalo prvi periodni sustav elemenata.
U studenom 1870. svojim je kolegama pokazao dodatak “Prirodni sustav elemenata i njegova upotreba u označavanju kvaliteta neotkrivenih elemenata.” U ovom djelu D.I. Mendeljejev prvi je upotrijebio izraz " periodični zakon" Mendeljejevljev sustav elemenata, temeljen na periodičnom zakonu, utvrdio je mogućnost postojanja neotkrivenih jednostavnih tvari i jasno ukazao na njihova svojstva.
Ispravci i pojašnjenja
Kao rezultat toga, do 1971. godine, Mendeljejevljev periodični zakon i elemente doradio je i dopunio ruski kemičar.
U završnom članku "Periodni zakon kemijskih elemenata" znanstvenik je postavio definiciju periodičkog zakona, koji kaže da su karakteristike jednostavnih tijela, svojstva spojeva, kao i složenih tijela koja oni tvore, određeni izravnim odnos prema njihovoj atomskoj težini.
Nešto kasnije, 1872. godine, struktura Mendeljejevljevog periodnog sustava reorganizirana je u klasični oblik (metoda distribucije kratkog perioda). 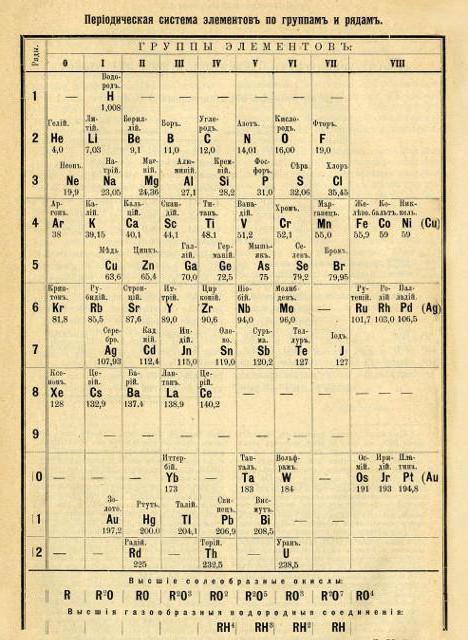
Za razliku od svojih prethodnika, ruski kemičar u potpunosti je sastavio tablicu i uveo koncept pravilnosti u atomskoj težini kemijskih elemenata.
Karakteristike elemenata Mendeljejeva periodnog sustava i izvedeni uzorci omogućili su znanstveniku da opiše svojstva elemenata koji još nisu otkriveni. Mendeljejev se oslanjao na činjenicu da se svojstva svake tvari mogu odrediti prema karakteristikama dva susjedna elementa. Ovo je nazvao pravilom "zvijezda". Njegova je bit da u tablici kemijskih elemenata, da biste odredili svojstva odabranog elementa, morate se kretati vodoravno i okomito u tablici kemijskih elemenata.
sposoban predvidjeti...
Periodni sustav elemenata, usprkos svojoj točnosti i vjernosti, znanstvena zajednica nije u potpunosti priznala. Neki veliki svjetski poznati znanstvenici otvoreno su ismijavali mogućnost predviđanja svojstava neotkrivenog elementa. Tek 1885. godine, nakon otkrića predviđenih elemenata - eka-aluminija, eka-bora i eka-silicija (galij, skandij i germanij), Mendeljejevljev novi klasifikacijski sustav i periodni zakon priznati su kao teorijska osnova kemija.
Početkom dvadesetog stoljeća struktura Mendelejevljevog periodnog sustava više je puta prilagođavana. U procesu dobivanja novih znanstvenih podataka, D. I. Mendeleev i njegov kolega U. Ramsay došli su do zaključka da je potrebno uvesti nultu skupinu. Uključuje inertne plinove (helij, neon, argon, kripton, ksenon i radon).
U tisuću devetsto jedanaestoj, F. Soddy je dao prijedlog da se nerazlučivi kemijski elementi - izotopi - smjeste u jednu ćeliju tablice.
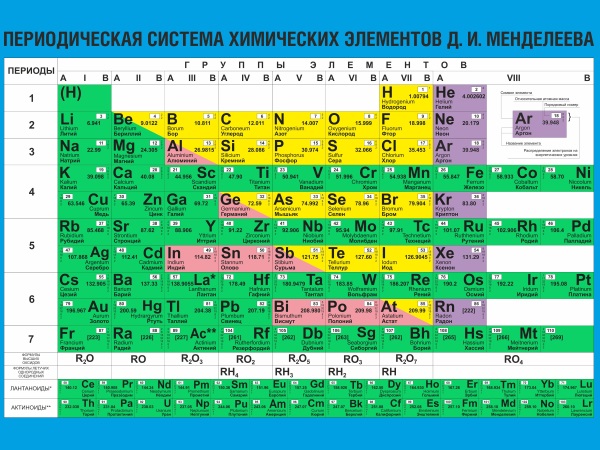
U procesu dugotrajnog i mukotrpnog rada, Mendelejevljev periodni sustav kemijskih elemenata konačno je finaliziran i dobio je moderan izgled. Sastojao se od osam skupina i sedam razdoblja. Grupe su okomiti stupci, točke su vodoravne. Grupe su podijeljene u podskupine. ![]()
Položaj elementa u tablici označava njegovu valenciju, neto elektrone i kemijska svojstva. Kako se kasnije pokazalo, tijekom razvoja tablice, D.I. Mendeleev je otkrio slučajnu podudarnost broja elektrona elementa s njegovim atomskim brojem. ![]() Ta je činjenica dodatno pojednostavila razumijevanje principa međudjelovanja jednostavnih tvari i nastanka složenih. I također proces u obrnuti smjer. Izračun količine dobivene tvari, kao i količine potrebne za odvijanje kemijske reakcije, postao je teoretski dostupan.
Ta je činjenica dodatno pojednostavila razumijevanje principa međudjelovanja jednostavnih tvari i nastanka složenih. I također proces u obrnuti smjer. Izračun količine dobivene tvari, kao i količine potrebne za odvijanje kemijske reakcije, postao je teoretski dostupan.
Uloga Mendeljejevljeva otkrića u modernoj znanosti
Mendeljejevljev sustav i njegov pristup uređenju kemijskih elemenata predodredili su daljnji razvoj kemije. Zahvaljujući ispravnom razumijevanju odnosa kemijskih konstanti i analize, Mendeljejev je uspio ispravno rasporediti i grupirati elemente prema njihovim svojstvima.  Nova tablica elemenata omogućuje jasno i točno izračunavanje podataka prije početka kemijske reakcije, predviđanje novih elemenata i njihovih svojstava.
Nova tablica elemenata omogućuje jasno i točno izračunavanje podataka prije početka kemijske reakcije, predviđanje novih elemenata i njihovih svojstava.
Otkriće ruskog znanstvenika imalo je izravan utjecaj na daljnji razvoj znanosti i tehnologije. Ne postoji tehnološko područje koje ne uključuje poznavanje kemije. Možda bi, da se takvo otkriće nije dogodilo, naša civilizacija krenula drugim putem razvoja.
U ovom trenutku službeno sadrži 118 kemikalija. Od toga, 94 su pronađena u prirodi, preostala 24 dobivena su umjetno kao rezultat nuklearnih reakcija. Od svih kemikalija pronađenih u prirodi, 88; elementi kao što je tehnecij Tc, prometij Pm, astatin Na i Francuskoj Fr, kao i svi elementi nakon urana, prvi su put dobiveni umjetnim putem. U normalnim uvjetima, odgovarajuće jednostavne tvari za 11 elemenata su plinovi, za 2 - tekućine, za preostale elemente - čvrste tvari.
Vrijedno čitanja
 Dmitrij Ivanovič Mendeljejev- ruski znanstvenik-enciklopedist, javna osoba. Kemičar, fizikokemičar, fizičar, metrolog, ekonomist, tehnolog, geolog, meteorolog, učitelj, aeronaut, instrumentar. profesor petrogradskog sveučilišta; Dopisni član u kategoriji "fizika" Carske peterburške akademije znanosti. Među naj poznata otkrića- periodični zakon kemijskih elemenata, jedan od temeljnih zakona svemira, sastavni dio cijele prirodne znanosti.
Dmitrij Ivanovič Mendeljejev- ruski znanstvenik-enciklopedist, javna osoba. Kemičar, fizikokemičar, fizičar, metrolog, ekonomist, tehnolog, geolog, meteorolog, učitelj, aeronaut, instrumentar. profesor petrogradskog sveučilišta; Dopisni član u kategoriji "fizika" Carske peterburške akademije znanosti. Među naj poznata otkrića- periodični zakon kemijskih elemenata, jedan od temeljnih zakona svemira, sastavni dio cijele prirodne znanosti.
Periodni sustav kemijskih elemenata– klasifikacija kemijskih elemenata, utvrđivanje ovisnosti različitih svojstava elemenata o naboju jezgre atoma. Sustav je grafički izraz periodičkog zakona koji je ustanovio ruski kemičar D.I. Mendeljejev 1869. godine. Njegovu početnu verziju razvio je D.I. Mendeljejev 1869-1871 i utvrdio ovisnost svojstava elemenata o njihovoj atomskoj težini. Ukupno je predloženo nekoliko stotina opcija za prikaz periodnog sustava. U modernoj verziji sustava pretpostavlja se da su elementi sažeti u dvodimenzionalnu tablicu, u kojoj svaki stupac definira glavna fizikalna i kemijska svojstva, a redovi predstavljaju razdoblja koja su u određenoj mjeri međusobno slična. . Do sredine 19. stoljeća otkrivena su 63 kemijska elementa, a pokušaji da se pronađu uzorci u ovom skupu ponavljani su. Češća od ostalih su 3 oblika periodnog sustava: "kratki", "dugi" i "ekstra-dugi". U "super-dugoj" verziji svaka točka zauzima točno jedan redak. Periodni sustav D.I. Mendeljejev je postao velika prekretnica u razvoju atomsko-molekularne znanosti.
U periodni sustav dodan je novi element
Neka od najpopularnijih kemijskih pitanja su: “Koliko je kemijskih elemenata sada poznato?”, “Koliko kemijskih elemenata postoji?”, “Tko ih je otkrio?”
Ova pitanja nemaju jednostavan i jednoznačan odgovor.
Što znači "poznato"? Ima li ih u prirodi? Na kopnu, u vodi, u svemiru? Jesu li njihova svojstva dobivena i proučena? Svojstva čega? Jesu li tvari u obliku faza ili samo na atomsko-molekularnoj razini? Dostupno moderne tehnologije omogućuju otkrivanje nekoliko atoma... Ali svojstva tvari ne mogu se odrediti iz jednog atoma.
Što znači "postojati"? U praktičnom smislu to je razumljivo: u prirodi su prisutni u tolikoj količini i toliko dugo da oni i njihovi spojevi mogu stvarno utjecati na prirodne pojave. Ili je barem bilo moguće proučavati njihova svojstva u laboratoriju.
U prirodi je identificirano oko 90 takvih kemijskih elemenata. Zašto toliko? Jer među elementima s rednim brojem manjim od 92 (prije urana), tehnecija (43) i francija (87) nema u prirodi. Praktično nema astatina (85), i neptunija (93) i plutonija (94) (nestabilni transuranijevi elementi) nalaze se u prirodi tamo gdje se nalaze rude urana. Svi elementi nakon plutonija Pu u periodnom sustavu D.I. Mendeljejeva potpuno su odsutni u zemljinoj kori, iako se neki od njih nedvojbeno formiraju u svemiru tijekom eksplozija supernove. Ali ne žive dugo...
Do danas su znanstvenici sintetizirali 26 transuranskih elemenata, počevši od neptunija (N=93) do elementa s brojem N=118 (broj elementa odgovara broju protona u atomskoj jezgri i broju elektrona oko atomske jezgre) .
Transuranijevi kemijski elementi od 93 do 100 proizvode se u nuklearnim reaktorima, a ostali se dobivaju kao rezultat nuklearnih reakcija u akceleratorima čestica. Tehnologija proizvodnje transuranijevih elemenata na akceleratorima je temeljno jasna: odgovarajuće pozitivno nabijene jezgre elemenata ubrzavaju se električnim poljem do potrebnih brzina i sudaraju s metom koja sadrži druge teže elemente - procesi fuzije i raspada atomskih jezgri raznih elemenata pojaviti se. Analiziraju se produkti tih procesa i donose zaključci o nastanku novih elemenata.
Njemački znanstvenici iz Helmholtz centra za proučavanje teških iona u nizu eksperimenata 2013.-2014. planirali su dobiti sljedeći, 119. element periodnog sustava, ali nisu uspjeli. Bombardirali su jezgre berkelija (N=97) jezgrama titana (N=22), ali analiza eksperimentalnih podataka nije potvrdila prisutnost novog elementa.
Trenutno se može smatrati utvrđenim postojanje sto osamnaest kemijskih elemenata. Izvješća o otkriću 119 - prvog elementa razdoblja 8 - za sada se mogu smatrati hipotetskim. Bilo je tvrdnji o sintezi elementa unbikvadija (124) i neizravnih dokaza o elementima unbiniliju (120) i unbiheksiju (126) - ali ti se rezultati još uvijek potvrđuju.
Sada, konačno, svih 118 do sada službeno poznatih i dokazanih elemenata imaju općeprihvaćena imena odobrena od strane IUPAC-a. Nedavno je najteži element koji je službeno priznat naziv bio 116. element koji ga je dobio u svibnju 2012. - livermorij. Istovremeno je službeno odobren naziv 114. elementa - flerovium.
Koliko kemijskih elemenata možete dobiti? Teoretski se predviđa mogućnost sinteze elemenata pod brojevima 121-126. To su brojevi protona u jezgrama elemenata. Problem donje granice periodnog sustava ostaje jedan od najvažnijih u modernoj teorijskoj kemiji.
Svaki kemijski element ima nekoliko izotopa. Izotopi su atomi čije jezgre imaju isti broj protona, ali različit broj neutrona. Svijet atomskih jezgri kemijskih elemenata vrlo je raznolik. Danas je poznato oko 3500 jezgri koje se međusobno razlikuju bilo po broju protona, bilo po broju neutrona, ili oboje. Većina ih se dobiva umjetnim putem. Pitanje je vrlo zanimljivo - koliko izotopa može imati određeni element?
Postoje 264 poznate atomske jezgre koje su stabilne, odnosno ne doživljavaju brze spontane transformacije tijekom vremena. Raspadanja.
Preostalih 3236 jezgri su osjetljive različite vrste radioaktivni raspad: alfa raspad (emisija alfa čestica – jezgri atoma helija); beta raspad (istovremena emisija elektrona i antineutrina ili pozitrona i neutrina, kao i apsorpcija elektrona uz emisiju neutrina); gama raspad (emisija fotona – elektromagnetski valovi visoke energije).
Od poznatih kemijskih elemenata Mendeljejevljevog periodnog sustava koji se nalaze na Zemlji, samo njih 75 ima točne i općeprihvaćene autore svog otkrića - detekcije i identifikacije. Samo pod tim uvjetima - detekcijom i identifikacijom - priznaje se otkriće kemijskog elementa.
U stvarnom otvoru - isticanje in čisti oblik i proučavanju svojstava - kemijskih elemenata koji se nalaze u prirodi sudjelovali su znanstvenici iz samo devet zemalja: Švedske (22 elementa), Engleske (19 elemenata), Francuske (15 elemenata), Njemačke (12 elemenata). Austrija, Danska, Rusija, Švicarska i Mađarska odgovorne su za otkriće preostalih 7 elemenata.
Ponekad označavaju Španjolsku (platina) i Finsku (itrij - 1794. godine finski kemičar Johan Gadolin otkrio je oksid nepoznatog elementa u švedskom mineralu iz Ytterbyja). Ali platina, kao plemeniti metal, poznata je u svom izvornom obliku od davnina - platinu u čistom obliku iz ruda dobio je engleski kemičar W. Wollaston 1803. godine. Ovaj znanstvenik poznatiji je kao pronalazač minerala volastonita.
Metal itrij prvi je dobio 1828. godine njemački znanstvenik Friedrich Wöhler.
Rekorderom među "lovcima" na kemijske elemente može se smatrati švedski kemičar K. Scheele - otkrio je i dokazao postojanje 6 kemijskih elemenata: fluor, klor, mangan, molibden, barij, volfram.
Dostignućima u otkrivanju kemijskih elemenata ovog znanstvenika može se pridodati i sedmi element - kisik, ali on službeno dijeli čast otkrića s engleskim znanstvenikom J. Priestleyem.
Drugo mjesto u otkriću novih elemenata pripada V. Ramsayu -
jednom engleskom ili točnije škotskom znanstveniku: otkrili su argon, helij, kripton, neon, ksenon. Usput, otkriće "helija" je vrlo zanimljivo. Ovo je prvo nekemijsko otkriće kemijskog elementa. Sada se pripisuje W. Ramsayu, ali su ga napravili drugi znanstvenici. Često se događa.
18. kolovoza 1868. francuski znanstvenik Pierre Jansen, u cijelosti pomrčina Sunca godine u indijskom gradu Gunturu po prvi put istraživao kromosferu Sunca. Namjestio je spektroskop na takav način da se spektar sunčeve korone može promatrati ne samo za vrijeme pomrčine, već iu običnim danima. Identificirao je, zajedno s linijama vodika - plavom, zeleno-plavom i crvenom - svijetlu žutu liniju, koju je isprva zamijenio s linijom natrija. Jansen je o tome pisao Francuskoj akademiji znanosti.
Naknadno je utvrđeno da se ova svijetlo žuta linija u Sunčevom spektru ne poklapa s linijom natrija i ne pripada niti jednom od ranije poznatih kemijskih elemenata.
27 godina nakon ovog inicijalnog otkrića, helij je otkriven na Zemlji - 1895., škotski kemičar William Ramsay, ispitujući uzorak plina dobivenog raspadom minerala kleveita, otkrio je u njegovom spektru istu svijetložutu liniju koja je prije bila pronađena u Suncu spektar. Uzorak je poslan na dodatno istraživanje poznatom engleskom spektroskopistu Williamu Crookesu, koji je potvrdio da se žuta linija uočena u spektru uzorka poklapa s D3 linijom helija.
Dana 23. ožujka 1895. Ramsay je poslao poruku o svom otkriću helija na Zemlji Kraljevskom društvu u Londonu, kao i Francuskoj akademiji preko poznatog kemičara Marcelina Berthelota. Tako je nastao naziv ovog kemijskog elementa. Od grčkog naziva za Sunce - helios. Napravljeno prvo otkriće spektralna metoda. Apsorpcijska spektroskopija.
U svim slučajevima Ramsay je imao koautore: W. Crooks (Engleska) - helij; W. Rayleigh (Engleska) - argon; M. Travers (Engleska) - kripton, neon, ksenon.
Pronađena su 4 elementa:
I. Berzelius (Švedska) - cerij, selen, silicij, torij;
G. Dewi (Engleska) - kalij, kalcij, natrij, magnezij;
P. Lecoq de Boisbaudran (Francuska) - galij, samarij, gadolinij, disprozij.
Rusija je zaslužna za otkriće samo jednog od prirodnih elemenata: rutenija (44). Naziv ovog elementa dolazi od kasnog latinskog naziva za Rusiju - Ruthenia. Ovaj element otkrio je profesor Karl Klaus sa sveučilišta u Kazanu 1844. godine.
Karl-Ernst Karlovich Klaus bio je ruski kemičar, autor niza radova o kemiji metala platinske skupine i pronalazač kemijskog elementa rutenija. Rođen je 11. (22.) siječnja 1796. - 12. (24. ožujka 1864.) u Dorpatu, drevnom ruskom gradu Yuryev (sada Tartu), u obitelji umjetnika. Godine 1837. obranio je svoju tezu za magisterij i imenovan je adjunktom na odjelu za kemiju na Sveučilištu u Kazanu. Od 1839. postao je profesor kemije na Sveučilištu u Kazanu, a od 1852. – profesor farmacije na Sveučilištu u Dorpatu. Godine 1861. postao je dopisni član Petrogradske akademije znanosti.
Sasvim je razumljiva činjenica da su većinu kemijskih elemenata poznatih u prirodi otkrili znanstvenici iz Švedske, Engleske, Francuske i Njemačke – u 18. i 19. stoljeću, kada su ti elementi otkriveni, upravo je u tim zemljama bilo najviše visoka razina razvoj kemije i kemijske tehnologije.
Još jedno zanimljivo pitanje: jesu li znanstvenice otkrile kemijske elemente?
Da. Ali malo. To su Marie Skladowska-Curie, koja je 1898. godine zajedno sa suprugom P. Curiejem otkrila polonij (naziv je dobio po svojoj domovini Poljskoj) i radij, Lise Meitner, koja je sudjelovala u otkriću protaktinija (1917.) , Ida Noddack (Tacke), koja je 1925. otkrila, zajedno sa svojim budućim suprugom V. Noddakom, Renius, i Margarita Perey, koja je 1939. otkrila Francusku i postala prva žena izabrana u Francusku akademiju znanosti.
U modernom periodnom sustavu postoji nekoliko elemenata, osim rutenija, čija su imena povezana s Rusijom: samarij (63) - od imena minerala samarskit, koji je otkrio ruski rudarski inženjer V.M. Samarsky u planinama Ilmen, mendelejev ( 101); dubnij (105). Zanimljiva je povijest naziva ovog elementa. Ovaj element je prvi put dobiven u akceleratoru u Dubni 1970. godine od strane grupe G.N.Flerova bombardiranjem jezgri 243Am ionima 22Ne i neovisno u Berkeleyu (SAD) u nuklearnoj reakciji 249Cf + 15N = 260Db + 4n.
Sovjetski su istraživači predložili da se novi element nazove nilsborij (Ns), u čast velikog danskog znanstvenika Nielsa Bohra, a američki ganij (Ha), u čast Otta Hahna, jednog od autora otkrića spontane fisije urana.
Radna skupina IUPAC je 1993. godine zaključio da zasluge za otkriće elementa 105 trebaju podijeliti grupe iz Dubne i Berkeleyja. Komisija IUPAC-a 1994. predložila je naziv joliotium (Jl), u čast Joliot-Curie. Prije toga, element se službeno nazivao latinskim brojem - unnilpentium (Unp), odnosno jednostavno 105. element. Simboli Ns, Na, Jl još uvijek se mogu vidjeti u tablicama elemenata objavljenim prethodnih godina. Na primjer, na Jedinstvenom državnom ispitu iz kemije 2013. Prema konačnoj odluci IUPAC-a 1997. godine, ovaj element je nazvan "dubnij" - u čast ruskog centra za istraživanje u području nuklearne fizike, znanstvenog grada Dubne.
Superteški kemijski elementi s rednim brojevima 113–118 prvi su put sintetizirani u Zajedničkom institutu za nuklearna istraživanja u Dubni u različito vrijeme. Element broj 114 nazvan je "flerovij" - u čast Laboratorija za nuklearne reakcije nazvanog po njemu. G.N. Flerov iz Zajedničkog instituta za nuklearna istraživanja, gdje je sintetiziran ovaj element.
Tijekom proteklih 50 godina, periodni sustav D.I. Mendeljejev je dopunjen sa 17 novih elemenata (102–118), od kojih je 9 sintetizirano u JINR-u, uključujući 5 najtežih (superteških) elemenata koji se zatvaraju periodni sustav elemenata…
Po prvi put 114. element ima “magični” broj protona (magični brojevi su niz prirodnih parnih brojeva koji odgovaraju broju nukleona u atomskoj jezgri pri kojem bilo koja njezina ljuska postaje potpuno ispunjena: 2, 8, 20, 28, 50, 82, 126 (posljednji broj je samo za neutrone) - dobila je grupa fizičara pod vodstvom Yu. Ts. Oganesyana u Zajedničkom institutu za nuklearna istraživanja (Dubna, Rusija) uz sudjelovanje znanstvenika iz Nacionalnog laboratorija Livermore (Livermore, SAD; Dubna-Livermore kolaboracija) u prosincu 1998. sintetizirajući izotope ovog elementa reakcijom fuzije jezgri kalcija s jezgrama plutonija, 30. svibnja 2012. odobren je naziv 114. elementa: “Flerovij” i simbolička oznaka Fl. Istovremeno je 116. element nazvan “livermorij” (Livermorium) (uzgred, životni vijek ovog elementa je 50 milisekundi).
Trenutno se sinteza transuranijevih elemenata uglavnom provodi u četiri zemlje: SAD, Rusiji, Njemačkoj i Japanu. U Rusiji se novi elementi dobivaju u Zajedničkom institutu za nuklearna istraživanja (JINR) u Dubni, u SAD-u - u Nacionalnom laboratoriju Oak Ridge u Tennesseeju i Nacionalnom laboratoriju Lawrence Livermore, u Njemačkoj - u Helmholtz centru za proučavanje Heavy Ions (također poznat kao Institut za teške ione) u Darmstadtu, u Japanu - na Institutu za fizička i kemijska istraživanja (RIKEN).
Za autorstvo stvaranja 113. elementa dugo se vodila borba između Japana i rusko-američke skupine znanstvenika. Japanski znanstvenici pod vodstvom Kosuke Morita sintetizirali su element 113 u rujnu 2004. ubrzavanjem i sudaranjem cinka-30 i bizmuta-83. Uspjeli su detektirati tri lanca raspada koji odgovaraju lancima rođenja 113. elementa 2004., 2005. i 2012. godine.
Ruski i američki znanstvenici najavili su stvaranje elementa 113 tijekom sinteze elementa 115 u Dubni u veljači 2004. i predložili da se nazove bekerelijem. Imenom izvanredan fizičar Antoine Henri Becquerel (15. prosinca 1852. - 25. kolovoza 1908.) bio je francuski fizičar, dobitnik Nobelove nagrade za fiziku i jedan od otkrivača radioaktivnosti.
Konačno, početkom 2016. godine, nazivi četiri nova kemijska elementa službeno su dodani u periodni sustav. Elemente s atomskim brojevima 113, 115, 117 i 118 potvrdila je Međunarodna unija za čistu i primijenjenu kemiju (IUPAC).
Čast otkrića elemenata 115, 117 i 118 dodijeljena je timu ruskih i američkih znanstvenika iz Zajedničkog instituta za nuklearna istraživanja u Dubni, Nacionalnog laboratorija Livermore u Kaliforniji i Nacionalnog laboratorija Oak Ridge u Tennesseeju.
Donedavno su ovi elementi (113, 115, 117 i 118) nosili ne baš zvučna imena ununtrija (Uut), ununpentij (Uup), ununsepcij (Uus) i ununoktij (Uuo), no u sljedećih pet mjeseci pronalazači elementi će im moći dati nova, konačna imena.
Znanstvenici s Japanskog instituta prirodnih znanosti (RIKEN) službeno su priznati kao pronalazači 113. elementa. U čast toga, preporučeno je nazvati element "Japan". Pravo na donošenje imena za preostale nove elemente dali su pronalazači, za što su dobili pet mjeseci, nakon čega bi ih službeno odobrilo vijeće IUPAC-a.
Predlaže se da se 115. element nazove "Moskovium" u čast Moskovske regije!
Gotovo je! 8. lipnja 2016 Međunarodna unija teorijska i primijenjena kemija objavila je preporučene nazive za 113., 115., 117. i 118. element periodnog sustava elemenata. To je objavljeno na web stranici sindikata.
Jedan od novih superteških elemenata periodnog sustava, broj 113, službeno je dobio naziv "nihonij" i simbol Nh. Odgovarajuću najavu objavio je japanski Institut prirodnih znanosti "Riken", čiji su stručnjaci ranije otkrili ovaj element.
Riječ "nihon" izvedena je iz lokalnog naziva zemlje - "Nihon".
Međunarodna unija za čistu i primijenjenu kemiju odobrila je nazive novih elemenata pod brojevima 113, 115, 117 i 118 - nihonij (Nh), moscovium (Mc), tennessine (Ts) i oganesson (Og).
113. element nazvan je u čast Japana, 115. - u čast Moskovske regije, 117. - u čast američke države Tennessee, 118. - u čast ruskog znanstvenika, akademika Ruske akademije znanosti Jurija Oganesyan.
Sergej, očito si mlad i ne osjećaš se dijelom naše zemlje. Razumljivo je ako ste mladi, ali ne izaziva poštovanje ako ste "građanin Moskve".
1. “Kako sam umoran od foteljaških političkih stručnjaka, hvalisavaca i neodgojenih skorojevića koji su otišli živjeti u tuđe zemlje, a sada u svakoj prilici pokušavaju obasuti “komplimentima” svoje bivše sunarodnjake.”
Kvragu s njima, oni nas ne zanimaju, mi imamo svoje sebične interese - kako MI trebamo živjeti.. Iako je šteta izgubiti takve ljude. To su, u najmanju ruku, ljudi koji se ne boje otrgnuti i započeti život ispočetka i s dna društvene ljestvice.
2. Ne razumijem ni agresiju stanovnika Ukrajine, ali zašto iskaljivati bijes na našim čitateljima ili novinarima našeg portala? ovo uopće.smireno komuniciraj o pseudoznanstvenim temama .I ti bi trebao pokazati svoje zube na drugim područjima, a ne samo vrijeđanjem drugih ljudi na internetu.
Hm... Onima koji su odgajani u Sovjetskom Savezu, normalno odgojenim, sjedi u podkorcu: "Ustani, ogromna zemljo..." kad neprijatelj uđe u našu zemlju. Slava Allahu i Budi što su grbovi individualisti i u biti ih nije bilo briga za svoju zemlju. Pa seru po internetu ili kunu prokletog Moskovljanina umjesto punog rata za svoj komadić zemlje... Koja bi vam opcija bila draža?
3. "Ono što se događa između naših političara je jedna stvar." “Mali pobjednički ratovi” su osmišljeni da izazovu patriotsko ludilo kod malih ljudi! Putinova podrška od 87% sasvim je realna, barem do pada rublja! I upravo je tih 87% odgovorno za ono što se događa s preostalih 13% i našim susjedima: “braća Gruzijci”, “braća Ukrajinci”.
4. Najvažnija stvar.
Čak i grbovi mogu zabiti gubitak dijela teritorija, kršenje ega i jaja. A mi moramo živjeti ovdje. A ti, Sergej, očito ne poznaješ povijest svoje obitelji ili je ona stajala po strani od onoga što se kod nas događalo.
I moja je obitelj krvlju povezana s ovom zemljom kroz mnoge generacije. Samo u 20. stoljeću: u 3 rata borilo se 6 ljudi, dvojica se nisu vratila. Od gladi umrlo 4 žene i djece. Počelo im je dosaditi. U logorima su umrle 4 osobe. Jedan je testirao atomsko oružje i umro od raka. Sin mu je preminuo u dobi od 24 godine od posljedica očeve izloženosti zračenju. Dva znanstvenika u obitelji, čelnici kemijske i energetske industrije, liječnici najviše kategorije, učitelj, vojnik koji je upao u Aminovu palaču.
I čemu sve ovo?? Ljudi su stvarali budućnost, bez budala, ne štedeći sebe i svoje zdravlje, ili su preživjeli zbog svoje djece. I sta vidimo??? K vragu i siromaštvo. Ali baština naših predaka se potpuno uništava. Gdje i kako će živjeti naša djeca? Prevara je postala norma na državnoj razini. Prema saveznim programima financiranja "Čiste vode", do 30% mora biti vraćeno u gotovini!! Mladi su glupi i nepismeni. Najjednostavnije natjecanje iz brojanja-pisanja-fizike-matematike prolazi 0,3-0,7% maturanata tehničkih sveučilišta! Od koga školovati inženjere, primijenjene znanstvenike??
Ima li puno ruske vijesti za 2015. radosnu za nas? Izbačen iz drugog međunarodnog programa? Još jedna "fija" iz drugih zemalja? Još jedan kolaps rublje? Ponovno gašenje proizvodnje i tržišta u cjelini?
Malo odraslih zna koliko je elemenata u periodnom sustavu. Osim toga, vaše znanje može biti zastarjelo.
Poanta je da je stol još unutra otvorena forma, odnosno nedovršeno, jer nisu poznate sve njegove komponente.
Kad bi kemičara pitali o količini poznati elementi potkraj 17. stoljeća pouzdano bi rekao da ih je bilo 21. A čak i kad je Mendeljejev razvio klasifikaciju kemijskih elemenata koja se i danas koristi (1869.-1871.), otkrivena su samo njih 63.
Pokušaji sistematizacije bili su više puta, ali vrlo je teško prosuđivati cjelinu po njezinim dijelovima, a još više u njoj tražiti uzorke.
Poteškoća je bila upravo u tome što tada znanstvenici nisu shvaćali da poznaju samo polovicu karika u postojećem lancu.
Ma koliko znanstvenici i istraživači pokušavali izgraditi polovicu njima poznate tablice. To nisu činili samo kemičari, već i glazbenici, tražeći sustav prema zakonu oktava.
Newlands je gotovo uspio, ali se kompromitirao mističnom pozadinom koju je gotovo pronašao u kemiji glazbene harmonije. Tek nekoliko godina nakon toga nastala je nama poznata tablica u kojoj se broj komponenti postupno povećavao sve do danas.
Možda je sustav u svojstvima ova 63 elementa otkrio, prema legendi, Mendeljejev u snu, ali on sam je rekao da se to nije dogodilo iznenada, ne na pucketanje prstiju. Kako bi pronašao uzorke, razmišljao je gotovo 20 godina. Štoviše, ostavljeni su prazni prostori za još neotkrivene karike u tom dugom lancu.
Daljnje širenje
DO kraj 19. stoljeća stoljeća tablica je već bila ispunjena s 84 elementa (razvijanje spektroskopije dalo je novi poticaj otkrićima), a sredinom 20. stoljeća dodano ih je još 13. Stoga su školarci 1950. mogli pouzdano ustvrditi da u periodici postoji 97 komponenti. stol.
Mendeljejeva tablica.
Od tada su elementi brojčani od 98 postupno otkrivani i proširivali tablicu nakon početka korištenja atomske energije. Tako su 2011. već bile popunjene 114. i 116. ćelija.
Početkom 2016. tablica je ponovno dopunjena - dodana su joj 4 nova elementa, iako su otkrivena mnogo ranije.
Njihovi atomski brojevi su 113, 115, 117 i 118, s tim da je jedan od kemijskih elemenata japanskog podrijetla (radni naziv ununtrij ili skraćeno Uut). Ovo je otkriće konačno omogućilo japanskim kemičarima, zajedno s ostalima, da uđu u periodni sustav elemenata, smjestivši svoje otkriće u 113. ćeliju.
Preostale elemente otkrila je rusko-američka skupina:
- ununpentij, ili Uup (115);
- ununseptium, ili Uus (117);
- ununoctium, ili Uuo (118).
Ovo su privremeni nazivi, au drugoj polovici 2016. pojavit će se u tablici prava imena i dvoslovne kratice. Pravo izbora imena pripada pronalazačima. Još se ne zna gdje će stati.
Imena mogu biti povezana s mitologijom, astronomijom, geografijom ili mogu biti pojmovi iz kemije ili možda imena znanstvenika.
Koliko ih je ukupno?
Čak i ako točno znate koliko se elemenata nalazi u periodnom sustavu, možete odgovoriti na dva načina i oba će odgovora biti točna.
Činjenica je da ova tablica ima dvije verzije. Jedna sadrži 118 komponenti, a druga 126.
Razlika između njih je u tome što su u prvoj verziji komponente već otvorene i službeno prihvaćene od strane znanstvene zajednice, au drugoj su uključene i hipotetske, odnosno postojeće samo na papiru iu glavama znanstvenika. Mogu se dobiti sutra, ili za 100 godina.
Ali u verziji od 118 elemenata sve komponente zapravo postoje. Od toga su 94 pronađena u prirodi, ostali su dobiveni u laboratoriju. Pa ipak, druga opcija također ima pravo postojati, jer priroda voli red.
Ako obrazac pokazuje da bi postojeći kemijski elementi trebali imati nastavak, to znači da će se on prije ili kasnije pojaviti zahvaljujući novim, još nepoznatim tehnologijama.
