Što je periodni sustav. Mendeljejev periodni sustav.
Periodni sustav elemenata kemijski elementi (periodni sustav)- klasifikacija kemijskih elemenata, utvrđivanje ovisnosti različitih svojstava elemenata o naboju atomske jezgre. Sustav je grafički izraz periodičkog zakona koji je ustanovio ruski kemičar D. I. Mendeljejev 1869. godine. Njegovu izvornu verziju razvio je D.I. Mendeljejev 1869.-1871. i utvrdio ovisnost svojstava elemenata o njihovoj atomskoj težini (u modernom smislu, o atomskoj masi). U modernoj verziji sustava pretpostavlja se da su elementi sažeti u dvodimenzionalnu tablicu u kojoj svaki stupac (skupina) definira glavna fizikalna i kemijska svojstva, a redovi predstavljaju razdoblja koja su u određenoj mjeri slična. jedno drugom.
Klasični prikaz periodnog sustava elemenata
Povijest otkrića periodnog zakona.
Do sredine 19. stoljeća otkrivena su 63 kemijska elementa, a pokušaji da se pronađu uzorci u ovom skupu ponavljani su.
Godine 1829. Döbereiner je objavio "zakon trijada" koji je otkrio: atomska težina mnogih elemenata je blizu aritmetičke sredine dva druga elementa koji su po kemijskim svojstvima bliski izvorniku (stroncij, kalcij i barij; klor, brom i jod, itd.). Prvi pokušaj rasporeda elemenata prema rastućim atomskim težinama napravio je Alexandre Emile Chancourtois (1862.), koji je postavio elemente duž spirale i uočio često cikličko ponavljanje kemijskih svojstava okomito. Oba ova modela nisu privukla pozornost znanstvene zajednice.
Godine 1866. kemičar i glazbenik John Alexander Newlands predložio je vlastitu verziju periodnog sustava, čiji je model (“zakon oktava”) pomalo nalikovao Mendeljejevom, ali je bio kompromitiran autorovim upornim pokušajima da pronađe mističnu glazbenu harmoniju u tablici. . U istom desetljeću pojavilo se još nekoliko pokušaja sistematizacije kemijskih elemenata; Najviše se konačnoj verziji približio Julius Lothar Meyer (1864.). D. I. Mendeljejev objavio je svoj prvi dijagram periodnog sustava 1869. godine u članku “Odnos svojstava s atomskom težinom elemenata” (u časopisu Ruskog kemijskog društva); Još ranije (veljača 1869.) poslao je znanstvenu obavijest o otkriću vodećim kemičarima svijeta.
Prema legendi, ideja o sustavu kemijskih elemenata došla je Mendelejevu u snu, no poznato je da je jednom prilikom na pitanje kako je otkrio periodni sustav, znanstvenik odgovorio: "Razmišljao sam o tome možda već dvadeset godina, a ti misliš: sjedio sam i odjednom... spreman".
Napisavši na kartice osnovna svojstva svakog elementa (tada su bila poznata 63, od kojih se za jednu - didimij Di - kasnije ispostavilo da je mješavina dva novootkrivena elementa prazeodimija i neodimija), Mendeljejev je počeo više puta preslagati te kartice , sastavljajući njihove redove s elementima sličnih svojstava, uspoređujući redove jedan s drugim. Rezultat rada bila je prva verzija sustava ("Iskustvo sustava elemenata na temelju njihove atomske težine i kemijske sličnosti"), poslana 1869. znanstvenim institucijama u Rusiji i drugim zemljama, u kojoj su elementi raspoređeni u devetnaest horizontalnih redova (redovi sličnih elemenata koji su postali skupine prototipova moderni sustav) i šest okomitih stupaca (prototipovi budućih razdoblja). Godine 1870. Mendeljejev je u “Osnovama kemije” objavio drugu verziju sustava (“Prirodni sustav elemenata”), koji ima nama poznatiji oblik: horizontalni stupci analognih elemenata pretvoreni u osam okomito raspoređenih grupa; šest okomitih stupaca prve verzije postali su razdoblja počevši s alkalnim metalom i završavajući s halogenom. Svako razdoblje bilo je podijeljeno u dvije serije; elementi različitih serija uključeni u skupinu formirali su podskupine.
Bit Mendelejevljeva otkrića bila je da se s povećanjem atomske mase kemijskih elemenata njihova svojstva ne mijenjaju monotono, već periodički. Nakon određenog broja elemenata s različitim svojstvima, raspoređenih u rastuću atomsku težinu, svojstva se počinju ponavljati. Na primjer, natrij je sličan kaliju, fluor je sličan kloru, a zlato je slično srebru i bakru. Naravno, svojstva im se ne ponavljaju točno; Razlika između Mendeljejevljeva rada i djela njegovih prethodnika bila je u tome što Mendeljejev nije imao jednu osnovu za klasifikaciju elemenata, već dvije - atomsku masu i kemijsku sličnost. Da bi se periodičnost u potpunosti poštovala, Mendeljejev je poduzeo vrlo hrabre korake: ispravio je atomske mase nekih elemenata (na primjer, berilija, indija, urana, torija, cerija, titana, itrija), postavio je nekoliko elemenata u svoj sustav nasuprot tada prihvaćenim idejama o njihovoj sličnosti s drugima (primjerice, talij, koji se smatrao alkalijskim metalom, svrstao je u treću skupinu prema stvarnoj maksimalnoj valenciji), ostavio prazna polja u tablici u kojima su još neotkriveni elementi trebalo postaviti. Godine 1871. na temelju tih radova Mendeljejev je formulirao Periodični zakon čiji je oblik s vremenom donekle poboljšan.
Znanstvena pouzdanost periodnog zakona potvrđena je vrlo brzo: 1875.-1886. otkriveni su galij (eka-aluminij), skandij (ekabor) i germanij (eka-silicij), za koje je Mendeljejev, koristeći periodni sustav, predvidio ne samo mogućnost njihova postojanja, ali i, s nevjerojatnom točnošću, niz fizikalnih i kemijskih svojstava.
Popis kemijskih elemenata periodnog sustava
- 1 H Vodik (a.m. 1,00794)
- 2 On Helij (a.m. 4.002602)
- 3 Li Litij (a.m. 6,9412)
- 4 Biti Berilij (a.m. 9,0122)
- 5 B Bor (a.m. 10,812)
- 6 S Ugljik (a.m. 12.011)
- 7 N Dušik (a.m. 14,0067)
- 8 OKO Kisik (a.m. 15,9994)
- 9 F Fluor (a.m. 18,9984)
- 10 ne Neon (am. 20.179)
- 11 Na Natrij (a.m. 22,98977)
- 12 Mg Magnezij (a.m. 24,305)
- 13 Al Aluminij (am. 26.98154)
- 14 Si Silicij (am. 28.086)
- 15 P Fosfor (a.m. 30,97376)
- 16 S
Oslanjao se na radove Roberta Boylea i Antoinea Lavuziera. Prvi znanstvenik zagovarao je potragu za nerazgradljivim kemijskim elementima. Boyle je 1668. naveo njih 15.
Lavouzier im je dodao još 13, ali stoljeće kasnije. Potraga se otegla jer nije postojala suvisla teorija o povezanosti elemenata. Konačno je u “igru” ušao Dmitrij Mendeljejev. Zaključio je da postoji veza između atomske mase tvari i njihovog mjesta u sustavu.
Ova teorija omogućila je znanstveniku da otkrije desetke elemenata, a da ih ne otkrije u praksi, već u prirodi. To je stavljeno na pleća potomaka. Ali sada se ne radi o njima. Posvetimo članak velikom ruskom znanstveniku i njegovom stolu.
Povijest nastanka periodnog sustava elemenata
Mendeljejeva tablica započeo je knjigom “Odnos svojstava s atomskom težinom elemenata”. Djelo je objavljeno 1870-ih. Istovremeno je ruski znanstvenik govorio pred kemijskim društvom zemlje i poslao prvu verziju tablice kolegama iz inozemstva.
Prije Mendeljejeva razni su znanstvenici otkrili 63 elementa. Naš sunarodnjak počeo je uspoređujući njihova svojstva. Prije svega, radio sam s kalijem i klorom. Zatim sam preuzeo skupinu metala alkalijske skupine.
Kemičar je nabavio poseban stol i karte elemenata kako bi ih igrao poput pasijansa, tražeći potrebne spojeve i kombinacije. Kao rezultat toga došlo se do spoznaje: - svojstva komponenata ovise o masi njihovih atoma. Tako, elementi periodnog sustava poredani.
Otkriće maestra kemije bila je odluka da u ovim redovima ostavi prazna mjesta. Periodičnost razlike između atomskih masa prisilila je znanstvenika da pretpostavi da nisu svi elementi poznati čovječanstvu. Razlike u težini između nekih "susjeda" bile su prevelike.

Zato, periodni sustav elemenata postao poput šahovskog polja, s obiljem "bijelih" ćelija. Vrijeme je pokazalo da su doista čekali svoje “goste”. Na primjer, postali su inertni plinovi. Helij, neon, argon, kripton, radioaktivnost i ksenon otkriveni su tek 30-ih godina 20. stoljeća.
Sada o mitovima. Uvriježeno je mišljenje da periodni kemijski sustav pojavio mu se u snu. To su makinacije sveučilišnih nastavnika, ili bolje rečeno, jednog od njih - Aleksandra Inostranceva. Riječ je o ruskom geologu koji je predavao na Sveučilištu rudarstva u Sankt Peterburgu.
Inostrancev je poznavao Mendeljejeva i posjećivao ga. Jednog dana, iscrpljen od potrage, Dmitrij je zaspao pred Aleksandrom. Pričekao je dok se kemičar ne probudi i ugleda Mendeljejeva kako zgrabi komad papira i zapiše konačnu verziju tablice.
Zapravo, znanstvenik jednostavno nije imao vremena za to prije nego što ga je Morpheus zarobio. Međutim, Inostrancev je želio zabaviti svoje učenike. Na temelju onoga što je vidio, geolog je smislio priču, koju su zahvalni slušatelji brzo proširili u mase.
Značajke periodnog sustava
Od prve verzije 1969 periodni sustav elemenata je izmijenjen više puta. Tako je otkrićem plemenitih plinova tridesetih godina prošlog stoljeća bilo moguće izvesti novu ovisnost elemenata – o njihovom atomskom broju, a ne o masi, kako je naveo autor sustava.
Koncept "atomske težine" zamijenjen je "atomskim brojem". Bilo je moguće proučavati broj protona u jezgrama atoma. Ova brojka je serijski broj elementa.
Znanstvenici 20. stoljeća također su proučavali elektronsku strukturu atoma. Također utječe na periodičnost elemenata i odražava se u kasnijim izdanjima Periodni sustavi. Fotografija Popis pokazuje da su tvari u njemu raspoređene kako se njihova atomska težina povećava.
Nisu promijenili temeljni princip. Masa se povećava s lijeva na desno. Istodobno, tablica nije jedinstvena, već je podijeljena na 7 razdoblja. Odatle i naziv liste. Točka je vodoravni red. Njegov početak su tipični metali, a kraj elementi s nemetalnim svojstvima. Smanjenje je postupno.
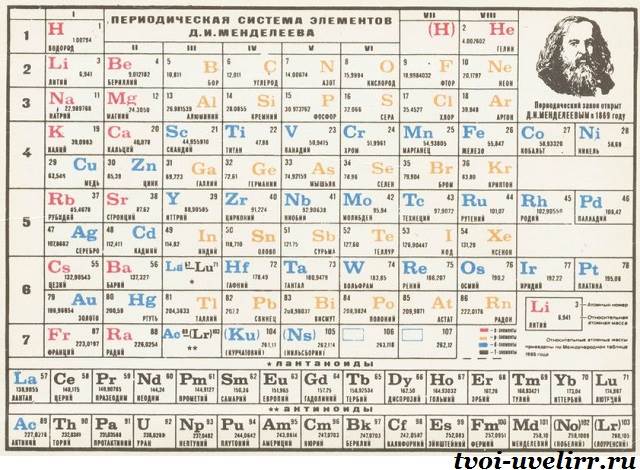
Postoje velika i mala razdoblja. Prvi su na početku tablice, ima ih 3. Točka od 2 elementa otvara listu. Slijede dva stupca, svaki sadržava 8 stavki. Preostale 4 periode su velike. Šesti je najduži, sa 32 elementa. U 4. i 5. ih je 18, a u 7. - 24.
Možete računati koliko je elemenata u tablici Mendeljejev. Ukupno ima 112 naslova. Imena naime. Ima 118 ćelija, a postoje i varijacije popisa sa 126 polja. Još uvijek postoje prazne ćelije za neotkrivene elemente koji nemaju imena.
Ne stanu sva razdoblja u jednu liniju. Velike točke sastoje se od 2 reda. Količina metala u njima je veća. Stoga su donji redovi u potpunosti posvećeni njima. U gornjim redovima uočava se postupno smanjenje od metala do inertnih tvari.
Slike periodnog sustava elemenata podijeljena i okomita. Ovaj skupine u periodnom sustavu, ima ih 8 elemenata sličnih kemijskih svojstava poredanih okomito. Dijele se na glavne i sekundarne podskupine. Potonji počinju tek od 4. razdoblja. Glavne podskupine također uključuju elemente malih razdoblja.
Suština periodnog sustava
Imena elemenata u periodnom sustavu– ovo je 112 pozicija. Suština njihovog slaganja u jedinstvenu listu je sistematizacija primarnih elemenata. Ljudi su se s tim počeli boriti još u davna vremena.
Aristotel je bio jedan od prvih koji je shvatio od čega su sve stvari napravljene. Za osnovu je uzeo svojstva tvari - hladnoću i toplinu. Empidokle je identificirao 4 temeljna elementa prema elementima: voda, zemlja, vatra i zrak.
Metali u periodnom sustavu, kao i drugi elementi, ista su temeljna načela, ali s modernog gledišta. Ruski kemičar uspio je otkriti većinu komponenti našeg svijeta i sugerirati postojanje još nepoznatih primarnih elemenata.

Ispostavilo se da izgovor periodnog sustava– izražavanje određenog modela naše stvarnosti, rastavljanje na sastavne dijelove. Međutim, naučiti ih nije tako lako. Pokušajmo olakšati zadatak opisom nekoliko učinkovitih metoda.
Kako naučiti periodni sustav
Počnimo s moderna metoda. Računalni znanstvenici razvili su brojne flash igrice koje pomažu u pamćenju Periodičnog popisa. Od sudionika projekta traži se da pronađu elemente koristeći različite opcije, na primjer, ime, atomsku masu ili slovnu oznaku.
Igrač ima pravo birati polje djelovanja - samo dio stola ili cijeli. Također je naš izbor isključiti nazive elemenata i druge parametre. To otežava pretragu. Za napredne postoji i mjerač vremena, odnosno trening se odvija na brzinu.
Uvjeti igre čine učenje broj elemenata u Mendlejevljevoj tablici nije dosadno, nego zabavno. Budi se uzbuđenje i postaje lakše sistematizirati znanje u glavi. Oni koji ne prihvaćaju računalne flash projekte nude tradicionalniji način pamćenja popisa.
Podijeljen je u 8 skupina, odnosno 18 (prema izdanju iz 1989.). Radi lakšeg pamćenja, bolje je izraditi nekoliko zasebnih tablica nego raditi na cijeloj verziji. Vizualne slike usklađene sa svakim od elemenata također pomažu. Trebali biste se osloniti na vlastite asocijacije.
Tako se željezo u mozgu može dovesti u korelaciju, primjerice, s čavlom, a živa s termometrom. Je li naziv elementa nepoznat? Koristimo se metodom sugestivnih asocijacija. , na primjer, izmislimo riječi "karamela" i "govornik" od početka.
Karakteristike periodnog sustava Nemojte učiti u jednom dahu. Preporučuju se vježbe od 10-20 minuta dnevno. Preporuča se započeti pamćenjem samo osnovnih karakteristika: naziva elementa, njegove oznake, atomske mase i serijskog broja.
Školarci više vole vješati periodni sustav iznad svog stola ili na zid u koji često gledaju. Metoda je dobra za osobe s prevladavajućim vizualnim pamćenjem. Podaci s popisa nehotice se pamte čak i bez nabijanja.
O tome vode računa i učitelji. U pravilu vas ne tjeraju da zapamtite popis, dopuštaju vam da ga pogledate čak i tijekom testova. Stalno gledanje u tablicu jednako je učinku ispisa na zidu ili pisanja varalica prije ispita.
Pri početku proučavanja, podsjetimo se da se Mendeljejev nije odmah sjetio svog popisa. Jednom, kada su jednog znanstvenika upitali kako je otkrio stol, odgovor je bio: "Razmišljam o tome možda 20 godina, ali vi mislite: sjedio sam tamo i odjednom je spreman." Periodni sustav je mukotrpan posao koji se ne može završiti u kratkom vremenu.

Znanost ne trpi žurbu, jer ona dovodi do zabluda i dosadnih pogrešaka. Dakle, u isto vrijeme kad i Mendeljejev, tablicu je sastavio i Lothar Meyer. Međutim, Nijemac je malo pogriješio u popisu i nije bio uvjerljiv u dokazivanju svoje tvrdnje. Dakle, javnost je prepoznala rad ruskog znanstvenika, a ne njegovog kolege kemičara iz Njemačke.
Čak iu školi, sjedeći na satovima kemije, svi se sjećamo stola na zidu učionice ili kemijskog laboratorija. Ova tablica sadržavala je klasifikaciju svih kemijskih elemenata poznatih čovječanstvu, onih temeljnih komponenti koje čine Zemlju i cijeli Svemir. Tada nismo mogli zamisliti da je periodni sustav nedvojbeno jedan od najvećih znanstvena otkrića, koji je temelj našeg modernog znanja o kemiji.
Na prvi pogled, njezina ideja izgleda varljivo jednostavna: organizirati elemente prema rastućoj težini njihovih atoma. Štoviše, u većini slučajeva ispada da su kemijska i fizikalna svojstva svakog elementa slična elementu koji mu prethodi u tablici. Ovaj obrazac se pojavljuje za sve elemente osim za nekoliko prvih, jednostavno zato što ispred sebe nemaju elemente slične sebi po atomskoj težini. Upravo zahvaljujući otkriću ovog svojstva možemo postaviti linearni niz elemenata u tablicu poput zidnog kalendara i tako kombinirati ogroman broj vrsta kemijskih elemenata u jasnom i koherentnom obliku. Naravno, danas koristimo koncept atomskog broja (broj protona) kako bismo uredili sustav elemenata. To je pomoglo u rješavanju tzv tehnički problem"par permutacija", međutim, nije doveo do fundamentalne promjene u izgledu periodnog sustava.
Periodni sustav raspoređuje sve elemente na temelju njihovog atomskog broja, elektronske konfiguracije i ponavljajućih kemijskih svojstava. Redovi u tablici nazivaju se periode, a stupci grupe. Prva tablica, koja datira iz 1869. godine, sadržavala je samo 60 elemenata, no sada se tablica morala povećati kako bi primila 118 elemenata koje danas poznajemo.

Svojstva Mendeljejevljeva periodnog sustava
Periodni sustav sistematizira ne samo elemente, već i njihova najrazličitija svojstva. Često je kemičaru dovoljno pred očima imati periodni sustav kako bi točno odgovorio na mnoga pitanja (ne samo ispitna, nego i znanstvena).

Pogledajmo ponovno periodni sustav. Uz duboku temeljnu vezu među elementima, odražava niz korisnih obrazaca za proučavanje kemije.
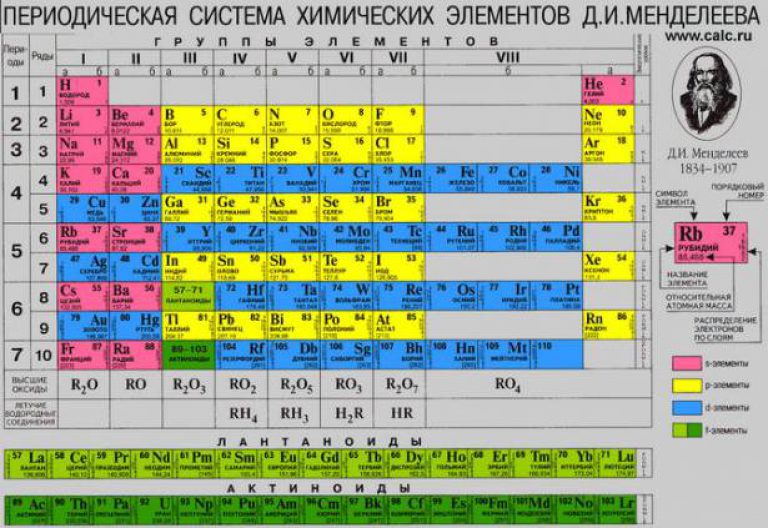
Razdoblja - horizontalne linije kemijski elementi.
grupe- okomiti stupci kemijskih elemenata.
Podskupine- A - glavni (s- i p-elementi) i B - sekundarni (d- i f-elementi).
Broj razdoblja- broj vanjske energetske razine u elektroničkoj formuli atoma elementa.
Broj grupe(za većinu elemenata) - ukupni broj valentni elektroni (elektroni vanjske energetske razine, kao i pretposljednje d-podrazine, ako nije potpuno popunjena).
Broj elemenata u razdoblju- najveći kapacitet odgovarajuće energetske razine:
1 period - 2 elementa (1s2)
2. period - 8 elemenata (2s2 2p6)
3. period - 8 elemenata (3s2 3p6)
4. period - 18 elemenata (4s2 3d10 4p6)
5. period - 18 elemenata (5s2 4d10 5p6)
6. period - 32 elementa (6s2 4f14 5d10 6p6)
7. razdoblje - nije dovršeno
Konstrukcija razdoblja- na početku: dva s-elementa, na kraju: šest p-elemenata. U četvrtoj i petoj periodi između njih se nalazi deset d-elemenata, au šestoj i sedmoj periodi dodaje im se četrnaest f-elemenata (oblika elektronskih orbitala).
Tijekom razdoblja- svojstva kemijskih elemenata međusobno se razlikuju jer su elektronske konfiguracije valentnih elektrona njihovih atoma različite.
U podskupini- svojstva elemenata su međusobno slična, jer su elektronske konfiguracije valentnih elektrona njihovih atoma slične. Razlog periodičnosti svojstava kemijskih elemenata leži u periodičnom ponavljanju sličnih elektroničkih konfiguracija vanjskih energetskih razina.

KLASIFIKACIJA KEMIJSKIH ELEMENATA PREMA SVOJSTVIMA
ALKALNI I ZEMNOALKALNI ELEMENTI
To uključuje elemente iz prve i druge skupine periodnog sustava. Alkalijski metali iz prve skupine - mekani metali, srebrnaste boje, lako se režu nožem. Svi oni imaju jedan elektron u svojoj vanjskoj ljusci i savršeno reagiraju. Zemnoalkalijski metali iz druge skupine također imaju srebrnastu nijansu. Dva elektrona smještena su na vanjskoj razini i, prema tome, ovi metali teže komuniciraju s drugim elementima. U usporedbi s alkalijskim metalima, zemnoalkalijski metali se tale i kuhaju na višim temperaturama.
LANTANIDI (ELEMENTI RIJETKIH ZEMLJA) I AKTINIDI
Lantanidi je skupina elemenata izvorno pronađenih u rijetkim mineralima; otuda i njihov naziv elementi "rijetke zemlje". Naknadno se pokazalo da ovi elementi nisu tako rijetki kao što se u početku mislilo, pa su stoga elementi rijetkih zemalja nazvani lantanidi. Lantanidi i aktinidi zauzimaju dva bloka, koji se nalaze ispod glavne tablice elemenata. Obje skupine uključuju metale; svi lantanidi (osim prometija) su neradioaktivni; aktinoidi su, naprotiv, radioaktivni.
HALOGENI I PLEMENITI PLINOVI
Halogeni i plemeniti plinovi grupirani su u skupine 17 i 18 periodnog sustava. Halogeni su nemetalni elementi, svi imaju sedam elektrona u svojoj vanjskoj ljusci. U plemeniti plinovi Svi elektroni nalaze se u vanjskoj ljusci, pa gotovo ne sudjeluju u stvaranju spojeva. Ti se plinovi nazivaju "plemenitim" plinovima jer rijetko reagiraju s drugim elementima; to jest, odnose se na pripadnike plemićke kaste koji su tradicionalno izbjegavali druge ljude u društvu.
PRIJELAZNI METALI
Prijelazni metali zauzimaju skupine 3-12 u periodnom sustavu. Većina ih je gusta, tvrda, dobre električne i toplinske vodljivosti. Njihovi valentni elektroni (pomoću kojih se povezuju s drugim elementima) nalaze se u nekoliko elektronskih ljuski.
| Prijelazni metali |
| Skandij Sc 21 |
| Titan Ti 22 |
| Vanadij V 23 |
| Krom Cr 24 |
| Mangan Mn 25 |
| Željezo Fe 26 |
| Cobalt Co 27 |
| Nikal Ni 28 |
| Bakar Cu 29 |
| Cink Zn 30 |
| Itrij Y 39 |
| Cirkonij Zr 40 |
| Niobij Nb 41 |
| Molibden Mo 42 |
| Tehnecij Tc 43 |
| Rutenij Ru 44 |
| Rodij Rh 45 |
| Paladij Pd 46 |
| Srebro Ag 47 |
| Kadmij Cd 48 |
| Lutecij Lu 71 |
| Hafnij Hf 72 |
| Tantal Ta 73 |
| Volfram W 74 |
| Renij Re 75 |
| Osmij Os 76 |
| Iridij Ir 77 |
| Platinasti Pt 78 |
| Zlato Au 79 |
| Merkur Hg 80 |
| Lawrence Lr 103 |
| Rutherfordium Rf 104 |
| Dubnij Db 105 |
| Seaborgium Sg 106 |
| Borium Bh 107 |
| Hassiy Hs 108 |
| Meitnerium Mt 109 |
| Darmstadt Ds 110 |
| Rtg Rg 111 |
| Kopernicij Cn 112 |
METALOIDI
Metaloidi zauzimaju skupine 13-16 periodnog sustava. Metaloidi kao što su bor, germanij i silicij su poluvodiči i koriste se za izradu računalnih čipova i sklopova.
POSLIJELAZNI METALI
Elementi tzv post-prijelazni metali, pripadaju skupinama 13-15 periodnog sustava elemenata. Za razliku od metala, oni nemaju sjaj, ali imaju mat boju. U usporedbi s prijelaznim metalima, postprijelazni metali su mekši, imaju niža tališta i vrelišta te veću elektronegativnost. Njihovi valentni elektroni, kojima spajaju druge elemente, nalaze se samo na vanjskoj elektronskoj ljusci. Elementi skupine metala nakon prijelaza imaju mnogo više točke vrelišta od metaloida.
NEMETALI
Od svih elemenata klasificiranih kao nemetali, vodik pripada skupini 1 periodnog sustava, a ostatak pripada skupinama 13-18. Nemetali nisu dobri vodiči toplinske i električne energije. Obično na sobnoj temperaturi postoje u plinovitom stanju (vodik ili kisik) ili krutom stanju (ugljik).
Super, prvi korak na putu do znanja je napravljen. Sada ste manje-više orijentirani u periodnom sustavu i to će vam biti vrlo korisno, jer je periodni sustav Mendeljejeva temelj na kojem stoji ova nevjerojatna znanost.
Jedna od najpopularnijih tablica na svijetu je periodni sustav. Svaka ćelija sadrži nazive kemijskih elemenata. Puno je truda uloženo u njegov razvoj. Uostalom, ovo nije samo popis tvari. Poredani su prema svojim svojstvima i karakteristikama. A sada ćemo saznati koliko je elemenata u periodnom sustavu.
Povijest stvaranja tablice
Mendeljejev nije bio prvi znanstvenik koji je odlučio strukturirati elemente. Mnogi su pokušali. Ali nitko nije mogao sve usporediti u jednoj koherentnoj tablici. Datumom otkrića periodičnog zakona možemo nazvati 17. veljače 1869. godine. Na današnji dan Mendeljejev je pokazao svoju kreaciju - cijeli sustav elemenata poredanih na temelju atomske težine i kemijskih karakteristika.
Vrijedno je napomenuti da briljantna ideja nije došla znanstveniku jedne sretne večeri dok je radio. Stvarno je radio oko 20 godina. Iznova sam prolazio kroz kartice s elementima, proučavajući njihove karakteristike. U isto vrijeme radili su i drugi znanstvenici.
Kemičar Cannizzaro predložio je u svoje ime teoriju atomske težine. Tvrdio je da upravo ti podaci mogu sastaviti sve tvari u pravom redoslijedu. Nadalje, znanstvenici Chanturquois i Newlands, radeći u različitim dijelovima svijeta, došli su do zaključka da se postavljanjem elemenata po atomskoj težini oni počinju dodatno sjedinjavati u drugim svojstvima.
Godine 1869. uz Mendeljejeva su predstavljeni i drugi primjeri tablica. Ali danas se ne sjećamo ni imena njihovih autora. Zašto je to? Sve je u nadmoći znanstvenika nad njegovim konkurentima:
- Stol je imao više otvorenih stavki od ostalih.
- Ako element nije odgovarao atomskoj težini, znanstvenik ga je postavljao na temelju drugih svojstava. I bila je to ispravna odluka.
- Na stolu je bilo mnogo praznih mjesta. Mendeljejev je namjerno napravio propuste i time oduzeo dio slave onima koji će te elemente pronaći u budućnosti. Čak je dao i opis nekih još nepoznatih tvari.
Najvažnije postignuće je to što je ovaj stol neuništiv. Stvoren je tako briljantno da će ga sva buduća otkrića samo nadopuniti.
Koliko ima elemenata u periodnom sustavu
Svatko je barem jednom u životu vidio ovu tablicu. Ali teško je nazvati točnu količinu tvari. Mogu postojati dva točna odgovora: 118 i 126. Sada ćemo shvatiti zašto je to tako.
U prirodi su ljudi otkrili 94 elementa. Nisu ništa radili s njima. Upravo smo proučavali njihova svojstva i karakteristike. Većina ih je bila u izvornom periodnom sustavu.
Ostala 24 elementa stvorena su u laboratorijima. Ukupno ima 118 komada. Ostalih 8 elemenata samo su hipotetske opcije. Pokušavaju ih izmisliti ili dobiti. Dakle, danas se sa sigurnošću može nazvati i opcija sa 118 elemenata i sa 126 elemenata.
- Znanstvenik je bio sedamnaesto dijete u obitelji. Osmero ih je umrlo u ranoj dobi. Moj otac je rano preminuo. Ali majka se nastavila boriti za budućnost svoje djece, pa ih je uspjela smjestiti u dobre obrazovne ustanove.
- Uvijek je branio svoje mišljenje. Bio je cijenjeni nastavnik na sveučilištima u Odesi, Simferopolju i St. Petersburgu.
- Nikad nije izmislio votku. Alkoholno piće nastalo je mnogo prije znanstvenika. No, njegov doktorat bio je posvećen alkoholu i otuda se razvila legenda.
- Mendeljejev nikada nije sanjao o periodnom sustavu. Bio je to rezultat napornog rada.
- Volio je izrađivati kofere. I doveo je svoj hobi do visoke razine umijeća.
- Tijekom svog života, Mendeljejev je mogao dobiti Nobelovu nagradu 3 puta. Ali sve je završilo samo na nominacijama.
- Mnoge će to iznenaditi, ali rad na polju kemije zauzima samo 10% ukupnih aktivnosti znanstvenika. Također je studirao aerostatiku i brodogradnju.

Periodni sustav je nevjerojatan sustav svih elemenata koje su ljudi ikada otkrili. Podijeljen je u retke i stupce kako bi se lakše naučili svi elementi.
p.s. Članak - Koliko elemenata ima u periodnom sustavu, objavljen u odjeljku -.
Neka od najpopularnijih kemijskih pitanja su: “Koliko je kemijskih elemenata sada poznato?”, “Koliko kemijskih elemenata postoji?”, “Tko ih je otkrio?”
Ova pitanja nemaju jednostavan i jednoznačan odgovor.
Što znači "poznato"? Ima li ih u prirodi? Na kopnu, u vodi, u svemiru? Jesu li njihova svojstva dobivena i proučena? Svojstva čega? Jesu li tvari u obliku faza ili samo na atomsko-molekularnoj razini? Dostupno moderne tehnologije omogućuju otkrivanje nekoliko atoma... Ali svojstva tvari ne mogu se odrediti iz jednog atoma.
Što znači "postojati"? U praktičnom smislu to je razumljivo: u prirodi su prisutni u tolikoj količini i toliko dugo da oni i njihovi spojevi mogu stvarno utjecati na prirodne pojave. Ili je barem bilo moguće proučavati njihova svojstva u laboratoriju.
U prirodi je identificirano oko 90 takvih kemijskih elemenata. Zašto toliko? Jer među elementima s rednim brojem manjim od 92 (prije urana), tehnecija (43) i francija (87) nema u prirodi. Praktično nema astatina (85), i neptunija (93) i plutonija (94) (nestabilni transuranijevi elementi) nalaze se u prirodi tamo gdje se nalaze rude urana. Svi elementi nakon plutonija Pu u periodnom sustavu D.I. Mendeljejeva potpuno su odsutni u zemljinoj kori, iako se neki od njih nedvojbeno formiraju u svemiru tijekom eksplozija supernove. Ali ne žive dugo...
Do danas su znanstvenici sintetizirali 26 transuranskih elemenata, počevši od neptunija (N=93) do elementa s brojem N=118 (broj elementa odgovara broju protona u atomskoj jezgri i broju elektrona oko atomske jezgre) .
Transuranijevi kemijski elementi od 93 do 100 proizvode se u nuklearnim reaktorima, a ostali se dobivaju kao rezultat nuklearnih reakcija u akceleratorima čestica. Tehnologija proizvodnje transuranijevih elemenata na akceleratorima je temeljno jasna: odgovarajuće pozitivno nabijene jezgre elemenata ubrzavaju se električnim poljem do potrebnih brzina i sudaraju s metom koja sadrži druge teže elemente - procesi fuzije i raspada atomskih jezgri raznih elemenata pojaviti se. Analiziraju se produkti tih procesa i donose zaključci o nastanku novih elemenata.
Njemački znanstvenici iz Helmholtz centra za proučavanje teških iona u nizu eksperimenata 2013.-2014. planirali su dobiti sljedeći, 119. element periodnog sustava, ali nisu uspjeli. Bombardirali su jezgre berkelija (N=97) jezgrama titana (N=22), ali analiza eksperimentalnih podataka nije potvrdila prisutnost novog elementa.
Trenutno se može smatrati utvrđenim postojanje sto osamnaest kemijskih elemenata. Izvješća o otkriću 119 - prvog elementa razdoblja 8 - za sada se mogu smatrati hipotetskim. Bilo je tvrdnji o sintezi elementa unbikvadija (124) i neizravnih dokaza o elementima unbiniliju (120) i unbiheksiju (126) - ali ti se rezultati još uvijek potvrđuju.
Sada, konačno, svih 118 do sada službeno poznatih i dokazanih elemenata imaju općeprihvaćena imena odobrena od strane IUPAC-a. Nedavno je najteži element koji je službeno priznat naziv bio 116. element koji ga je dobio u svibnju 2012. - livermorij. Istovremeno je službeno odobren naziv 114. elementa - flerovium.
Koliko kemijskih elemenata možete dobiti? Teoretski se predviđa mogućnost sinteze elemenata pod brojevima 121-126. To su brojevi protona u jezgrama elemenata. Problem donje granice periodnog sustava ostaje jedan od najvažnijih u modernoj teorijskoj kemiji.
Svaki kemijski element ima nekoliko izotopa. Izotopi su atomi čije jezgre imaju isti broj protona, ali različit broj neutrona. Svijet atomskih jezgri kemijskih elemenata vrlo je raznolik. Danas je poznato oko 3500 jezgri koje se međusobno razlikuju bilo po broju protona, bilo po broju neutrona, ili oboje. Većina ih se dobiva umjetnim putem. Pitanje je vrlo zanimljivo - koliko izotopa može imati određeni element?
Postoje 264 poznate atomske jezgre koje su stabilne, odnosno ne doživljavaju brze spontane transformacije tijekom vremena. Raspadanja.
Preostalih 3236 jezgri su osjetljive različite vrste radioaktivni raspad: alfa raspad (emisija alfa čestica – jezgri atoma helija); beta raspad (istovremena emisija elektrona i antineutrina ili pozitrona i neutrina, kao i apsorpcija elektrona uz emisiju neutrina); gama raspad (emisija fotona – elektromagnetski valovi visoke energije).
Od poznatih kemijskih elemenata Mendeljejevljeva periodnog sustava koji se nalaze na Zemlji, samo njih 75 ima točne i općeprihvaćene autore svog otkrića – detekcije i identifikacije. Samo pod tim uvjetima - detekcijom i identifikacijom - priznaje se otkriće kemijskog elementa.
U stvarnom otvoru - isticanje in čisti oblik i proučavanju svojstava - kemijskih elemenata koji se nalaze u prirodi sudjelovali su znanstvenici iz samo devet zemalja: Švedske (22 elementa), Engleske (19 elemenata), Francuske (15 elemenata), Njemačke (12 elemenata). Austrija, Danska, Rusija, Švicarska i Mađarska odgovorne su za otkriće preostalih 7 elemenata.
Ponekad označavaju Španjolsku (platina) i Finsku (itrij - 1794. godine finski kemičar Johan Gadolin otkrio je oksid nepoznatog elementa u švedskom mineralu iz Ytterbyja). Ali platina, kao plemeniti metal, poznata je u svom izvornom obliku od davnina - platinu u čistom obliku iz ruda dobio je engleski kemičar W. Wollaston 1803. godine. Ovaj znanstvenik poznatiji je kao pronalazač minerala volastonita.
Metal itrij prvi je dobio 1828. godine njemački znanstvenik Friedrich Wöhler.
Rekorderom među "lovcima" na kemijske elemente može se smatrati švedski kemičar K. Scheele - otkrio je i dokazao postojanje 6 kemijskih elemenata: fluor, klor, mangan, molibden, barij, volfram.
Dostignućima u otkrivanju kemijskih elemenata ovog znanstvenika može se pridodati i sedmi element - kisik, no on službeno dijeli čast otkrića s engleskim znanstvenikom J. Priestleyem.
Drugo mjesto u otkriću novih elemenata pripada V. Ramsayu -
jednom engleskom ili točnije škotskom znanstveniku: otkrili su argon, helij, kripton, neon, ksenon. Usput, otkriće "helija" je vrlo zanimljivo. Ovo je prvo nekemijsko otkriće kemijskog elementa. Sada se pripisuje W. Ramsayu, ali su ga napravili drugi znanstvenici. Često se događa.
18. kolovoza 1868. francuski znanstvenik Pierre Jansen, u cijelosti pomrčina Sunca godine u indijskom gradu Gunturu po prvi put istraživao kromosferu Sunca. Namjestio je spektroskop na takav način da se spektar sunčeve korone može promatrati ne samo za vrijeme pomrčine, već iu običnim danima. Identificirao je, zajedno s linijama vodika - plavom, zeleno-plavom i crvenom - svijetlu žutu liniju, koju je isprva zamijenio s linijom natrija. Jansen je o tome pisao Francuskoj akademiji znanosti.
Naknadno je utvrđeno da se ova svijetlo žuta linija u Sunčevom spektru ne poklapa s linijom natrija i ne pripada niti jednom od ranije poznatih kemijskih elemenata.
27 godina nakon ovog inicijalnog otkrića, helij je otkriven na Zemlji - 1895., škotski kemičar William Ramsay, ispitujući uzorak plina dobivenog raspadom minerala kleveita, otkrio je u njegovom spektru istu svijetložutu liniju koja je prije bila pronađena u Suncu spektar. Uzorak je poslan na dodatno istraživanje poznatom engleskom spektroskopistu Williamu Crookesu, koji je potvrdio da se žuta linija uočena u spektru uzorka poklapa s D3 linijom helija.
Dana 23. ožujka 1895. Ramsay je poslao poruku o svom otkriću helija na Zemlji Kraljevskom društvu u Londonu, kao i Francuskoj akademiji preko poznatog kemičara Marcelina Berthelota. Tako je nastao naziv ovog kemijskog elementa. Od grčkog naziva za Sunce - helios. Napravljeno prvo otkriće spektralna metoda. Apsorpcijska spektroskopija.
U svim slučajevima Ramsay je imao koautore: W. Crooks (Engleska) - helij; W. Rayleigh (Engleska) - argon; M. Travers (Engleska) - kripton, neon, ksenon.
Pronađena su 4 elementa:
I. Berzelius (Švedska) - cerij, selen, silicij, torij;
G. Dewi (Engleska) - kalij, kalcij, natrij, magnezij;
P. Lecoq de Boisbaudran (Francuska) - galij, samarij, gadolinij, disprozij.
Rusija je zaslužna za otkriće samo jednog od prirodnih elemenata: rutenija (44). Naziv ovog elementa dolazi od kasnog latinskog naziva za Rusiju - Ruthenia. Ovaj element otkrio je profesor Karl Klaus sa sveučilišta u Kazanu 1844. godine.
Karl-Ernst Karlovich Klaus bio je ruski kemičar, autor niza radova o kemiji metala platinske skupine i pronalazač kemijskog elementa rutenija. Rođen je 11. (22.) siječnja 1796. - 12. (24. ožujka 1864.) u Dorpatu, drevnom ruskom gradu Yuryev (sada Tartu), u obitelji umjetnika. Godine 1837. obranio je svoju tezu za magisterij i imenovan je adjunktom na odjelu za kemiju na Sveučilištu u Kazanu. Od 1839. postao je profesor kemije na Sveučilištu u Kazanu, a od 1852. – profesor farmacije na Sveučilištu u Dorpatu. Godine 1861. postao je dopisni član Petrogradske akademije znanosti.
Sasvim je razumljiva činjenica da su većinu kemijskih elemenata poznatih u prirodi otkrili znanstvenici iz Švedske, Engleske, Francuske i Njemačke - u 18.-19. stoljeću, kada su ti elementi otkriveni, upravo je u tim zemljama bilo najviše visoka razina razvoj kemije i kemijske tehnologije.
Još jedno zanimljivo pitanje: jesu li znanstvenice otkrile kemijske elemente?
Da. Ali malo. To su Marie Skladowska-Curie, koja je 1898. godine, zajedno sa svojim suprugom P. Curiejem, otkrila polonij (naziv je dobio po svojoj domovini Poljskoj) i radij, Lise Meitner, koja je sudjelovala u otkriću protaktinija (1917.) , Ida Noddack (Tacke), koja je 1925. otkrila, zajedno sa svojim budućim suprugom V. Noddakom, Renius, i Margarita Perey, koja je 1939. otkrila Francusku i postala prva žena izabrana u Francusku akademiju znanosti.
U modernom periodnom sustavu postoji nekoliko elemenata, osim rutenija, čija su imena povezana s Rusijom: samarij (63) - od imena minerala samarskit, koji je otkrio ruski rudarski inženjer V.M. Samarsky u planinama Ilmen, mendelejev ( 101); dubnij (105). Zanimljiva je povijest imena ovog elementa. Ovaj element je prvi put dobiven u akceleratoru u Dubni 1970. godine od strane grupe G.N.Flerova bombardiranjem jezgri 243Am ionima 22Ne i neovisno u Berkeleyu (SAD) u nuklearnoj reakciji 249Cf + 15N = 260Db + 4n.
Sovjetski su istraživači predložili da se novi element nazove nilsborij (Ns), u čast velikog danskog znanstvenika Nielsa Bohra, a američki ganij (Ha), u čast Otta Hahna, jednog od autora otkrića spontane fisije urana.
Radna skupina IUPAC je 1993. godine zaključio da zasluge za otkrivanje elementa 105 trebaju podijeliti grupe iz Dubne i Berkeleyja. Komisija IUPAC-a 1994. predložila je naziv joliotium (Jl), u čast Joliot-Curie. Prije toga, element se službeno nazivao latinskim brojem - unnilpentium (Unp), odnosno jednostavno 105. element. Simboli Ns, Na, Jl još uvijek se mogu vidjeti u tablicama elemenata objavljenim prethodnih godina. Na primjer, na Jedinstvenom državnom ispitu iz kemije 2013. Prema konačnoj odluci IUPAC-a 1997. godine, ovaj element je nazvan "dubnij" - u čast ruskog centra za istraživanje u području nuklearne fizike, znanstvenog grada Dubne.
Superteški kemijski elementi s rednim brojevima 113–118 prvi su put sintetizirani u Zajedničkom institutu za nuklearna istraživanja u Dubni u različito vrijeme. Element broj 114 nazvan je "flerovij" - u čast Laboratorija za nuklearne reakcije nazvanog po njemu. G.N. Flerov iz Zajedničkog instituta za nuklearna istraživanja, gdje je sintetiziran ovaj element.
Tijekom proteklih 50 godina, periodni sustav D.I. Mendeljejev je dopunjen sa 17 novih elemenata (102–118), od kojih je 9 sintetizirano u JINR-u, uključujući 5 najtežih (superteških) elemenata koji se zatvaraju periodni sustav elemenata…
Po prvi put 114. element ima “magični” broj protona (magični brojevi su niz prirodnih parnih brojeva koji odgovaraju broju nukleona u atomskoj jezgri pri kojem bilo koja njezina ljuska postaje potpuno ispunjena: 2, 8, 20, 28, 50, 82, 126 (posljednji broj je samo za neutrone) - dobila je grupa fizičara pod vodstvom Yu. Ts. Oganesyana u Zajedničkom institutu za nuklearna istraživanja (Dubna, Rusija) uz sudjelovanje znanstvenika iz Nacionalnog laboratorija Livermore (Livermore, SAD; Dubna-Livermore kolaboracija) u prosincu 1998. sintetizirajući izotope ovog elementa reakcijom fuzije jezgri kalcija s jezgrama plutonija, 30. svibnja 2012. odobren je naziv 114. elementa: “Flerovij” i simbolička oznaka Fl. Istovremeno je 116. element nazvan “livermorij” (Livermorium) (uzgred, životni vijek ovog elementa je 50 milisekundi).
Trenutno se sinteza transuranijevih elemenata uglavnom provodi u četiri zemlje: SAD, Rusiji, Njemačkoj i Japanu. U Rusiji se novi elementi dobivaju u Zajedničkom institutu za nuklearna istraživanja (JINR) u Dubni, u SAD-u - u Nacionalnom laboratoriju Oak Ridge u Tennesseeju i Nacionalnom laboratoriju Lawrence Livermore, u Njemačkoj - u Helmholtz centru za proučavanje Heavy Ions (također poznat kao Institut za teške ione) u Darmstadtu, u Japanu - na Institutu za fizička i kemijska istraživanja (RIKEN).
Za autorstvo stvaranja 113. elementa dugo se vodila borba između Japana i rusko-američke skupine znanstvenika. Japanski znanstvenici pod vodstvom Kosuke Morita sintetizirali su element 113 u rujnu 2004. ubrzavanjem i sudaranjem cinka-30 i bizmuta-83. Uspjeli su detektirati tri lanca raspada koji odgovaraju lancima rođenja 113. elementa 2004., 2005. i 2012. godine.
Ruski i američki znanstvenici najavili su stvaranje elementa 113 tijekom sinteze elementa 115 u Dubni u veljači 2004. i predložili da se nazove bekerelijem. Imenom izvanredan fizičar Antoine Henri Becquerel (15. prosinca 1852. - 25. kolovoza 1908.) bio je francuski fizičar, dobitnik Nobelove nagrade za fiziku i jedan od otkrivača radioaktivnosti.
Konačno, početkom 2016. godine, nazivi četiri nova kemijska elementa službeno su dodani u periodni sustav. Elemente s atomskim brojevima 113, 115, 117 i 118 potvrdila je Međunarodna unija za čistu i primijenjenu kemiju (IUPAC).
Čast otkrića elemenata 115, 117 i 118 dodijeljena je timu ruskih i američkih znanstvenika iz Zajedničkog instituta za nuklearna istraživanja u Dubni, Nacionalnog laboratorija Livermore u Kaliforniji i Nacionalnog laboratorija Oak Ridge u Tennesseeju.
Donedavno su ovi elementi (113, 115, 117 i 118) nosili ne baš zvučna imena ununtrija (Uut), ununpentij (Uup), ununsepcij (Uus) i ununoktij (Uuo), no u sljedećih pet mjeseci pronalazači elementi će im moći dati nova, konačna imena.
Znanstvenici s Japanskog instituta prirodnih znanosti (RIKEN) službeno su priznati kao pronalazači 113. elementa. U čast toga, preporučeno je nazvati element "Japan". Pravo da smisle nazive za preostale nove elemente dali su pronalazači, za što su dobili pet mjeseci, nakon čega bi ih službeno odobrilo vijeće IUPAC-a.
Predlaže se da se 115. element nazove "Moskovium" u čast Moskovske regije!
Gotovo je! 8. lipnja 2016 Međunarodna unija teorijska i primijenjena kemija objavila je preporučene nazive za 113., 115., 117. i 118. element periodnog sustava elemenata. To je objavljeno na web stranici sindikata.
Jedan od novih superteških elemenata periodnog sustava, broj 113, službeno je dobio naziv "nihonij" i simbol Nh. Odgovarajuću najavu objavio je japanski Institut prirodnih znanosti "Riken", čiji su stručnjaci ranije otkrili ovaj element.
Riječ "nihon" izvedena je iz lokalnog naziva zemlje - "Nihon".
Međunarodna unija za čistu i primijenjenu kemiju odobrila je nazive novih elemenata pod brojevima 113, 115, 117 i 118 - nihonij (Nh), moscovium (Mc), tennessine (Ts) i oganesson (Og).
113. element nazvan je u čast Japana, 115. - u čast Moskovske regije, 117. - u čast američke države Tennessee, 118. - u čast ruskog znanstvenika, akademika Ruske akademije znanosti Jurija Oganesyan.
