Псхэ химия. Периодическая система менделеева и периодический закон.
Одни из самых популярных химических вопросов: "Сколько сейчас известно химических элементов?", "Сколько существует химических элементов?", "Кто их открыл?"
Эти вопросы не имеют простого и однозначного ответа.
Что значит "известно"? Встречаются в природе? На земле, в воде, в космосе? Получены и изучены их свойства? Свойства чего? Вещества в виде фаз или только на атомно-молекулярном уровне? Имеющиеся современные технологии позволяют обнаруживать и несколько атомов... Но, по отдельному атому свойства вещества не определить.
А что значит "существуют"? В практическом плане это понятно: наличествуют в природе в таком количестве и столько времени, чтобы они и их соединения могли оказывать реальное влияние на природные явления. Или хотя бы можно было изучить их свойства в лаборатории.
Таковых химических элементов в природе выявлено около 90. Почему около? Потому, что среди элементов с порядковым номером менее 92 (до урана) в природе отсутствуют технеций (43) и франций (87). Практически нет астата (85).С другой стороны, и нептуний (93) и плутоний (94) (нестабильные трансурановые элементы) обнаруживаются в природе там, где встречаются урановые руды. Все элементы следующие после плутония Pu в периодической системе Д.И.Менделеева в земной коре полностью отсутствуют, хотя некоторые из них несомненно образуются в космосе во время взрывов сверхновых звёзд. Но долго они не живут...
К настоящему времени ученые синтезировали 26 трансурановых элементов, начиная с нептуния (N=93) и заканчивая элементом с номером N=118 (номер элемента соответствует числу протонов в ядре атома и числу электронов вокруг ядра атома).
Трансурановые химические элементы от 93 до 100 получают в ядерных реакторах, а остальные - в результате ядерных реакций на ускорителях частиц. Технология получения трансурановых элементов на ускорителях принципиально понятна: разгоняют подходящие положительно заряженные остовы ядрер элементов электрическим полем до нужных скоростей и сталкивают их с мишенью, содержащей другие более тяжёлые элементы - происходят процессы слияния и распада атомных ядер различных элементов. Продукты этих процессов анализируют и делают выводы об образовании новых элементов.
Немецкие ученые из Центра по изучению тяжелых ионов Гельмгольца в серии экспериментов 2013-2014 годов планировали получить следующий, 119 элемент таблицы Менделеева, но потерпели неудачу. Они обстреливали ядра берклия (N=97) ядрами титана (N=22), однако анализ данных эксперимента не подтвердил наличия нового элемента.
В настоящее время можно считать идентифицированным существование ста восемнадцати химических элементов. Сообщения об обнаружении 119-го - первого элемента 8 периода - можно пока считать гипотетическим. Были заявления о синтезе элемента унбиквадий (124) и косвенные свидетельства об элементах унбинилий (120) и унбигексий (126), - но эти результаты ещё находятся в стадии подтверждения.
Сейчас, наконец, все, из официально известных и доказанных на сегодня 118 элементов, имеют утвержденные ИЮПАК общепризнанные названия. Не так давно самым тяжёлым из элементов, имеющих официально признанное название, был 116-й элемент, получивший его в мае 2012 года - ливерморий. Тогда же было официально утверждено название 114-го элемента - флеровий.
Сколько химических элементов вообще можно получить? Теоретически предсказывается возможность синтеза элементов с номерами 121-126. Это числа протонов в ядрах элементов. Проблема нижней границы таблицы Менделеева остаётся одной из важнейших в современной теоретической химии.
У каждого химического элемента имеется несколько изотопов. Изотопы - это атомы в ядрах которых имеется одинаковое число протонов, но разное количество нейтронов. Мир атомных ядер химических элементов очень разнообразен. Сейчас известно около 3500 ядер, отличающихся друг от друга либо числом протонов, либо числом нейтронов, либо тем и другим. Большинство из них получено искусственным путём. Вопрос очень интересный - сколько у данного элемента может быть изотопов?
Известно 264 ядра атомов, которые стабильны, то есть не испытывают со временем никаких быстрых самопроизвольных превращений. Распадов.
Остальные ядра в количестве 3236 подвержены различным видам радиоактивного распада: альфа-распаду (испускание альфа-частиц - ядер атома гелия); бета-распаду (одновременное испускание электрона и антинейтрино или позитрона и нейтрино, а также поглощение электрона с испусканием нейтрино); гамма-распаду (испускание фотонов - электромагнитных волн высокой энергии).
Из известных химических элементов периодической системы Менделеева, которые встречаются на Земле, только для 75 имеются точно и общепризнанно установленные авторы их открытия - обнаружение и идентификация. только при этих условиях - обнаружение и идентификация - признаётся факт открытия химического элемента.
В действительном открытии - выделение в чистом виде и изучении свойств - химических элементов, встречающихся в природе, участвовали учёные всего лишь девяти стран: Швеция (22 элемента), Англия (19 элементов), Франция (15 элементов), Германия (12 элементов). На Австрию, Данию, Россию, Швейцарию и Венгрию приходится открытие остальных 7 элементов.
Иногда указывают Испанию (платина) и Финляндию (иттрий - в 1794 году в шведском минерале из Иттербю финский химик Юхан Гадолин обнаружил оксид неизвестного элемента). Но платина, как благородный металл, была известна в самородном виде с древних времён - в чистом виде из руд платина была получена английским химиком У.Волластоном в 1803 году. Этот учёный более известен как открыватель минерала волластонита.
Металлический иттрий впервые получил в 1828 г. немецкий ученый Фридрих Велер.
Рекордсменом среди "охотников" за химическими элементами можно считать шведского химика К. Шееле - он обнаружил и доказал существование 6-ти химических элементов: фтора, хлора, марганца, молибдена, бария, вольфрама.
К достижениям в находках химических элементов этого учёного можно добавить ещё и седьмой элемент - кислород, но честь открытия которого он официально делит с английским учёным Дж. Пристли.
Второе место в открытии новых элементов принадлежит В.Рамзаю -
английскому или, точнее, шотландскому учёному: им открыты аргон, гелий, криптон, неон, ксенон. Кстати, открытие "гелия" очень любопытно. Это первое не "химическое" открытие химического элемента. Оно приписывается сейчас У.Рамзаю, но было сделано другими учёными. Так часто бывает.
18 августа 1868 года французский учёный Пьер Жансен, при полном солнечном затмении в индийском городе Гунтур, впервые исследовал хромосферу Солнца. Он настроил спектроскоп таким образом, что спектр короны Солнца удалось наблюдать не только при затмении, но и в обычные дни. Он выявил наряду с линиями водорода - синей, зелено-голубой и красной - яркую жёлтую линию, первоначально принятую им за линию натрия. Жансен написал об этом во Французскую академию наук.
Впоследствии было установлено, что эта ярко-жёлтая линия в солнечном спектре не совпадает с линией натрия и не принадлежит ни одному из ранее известных химических элементов.
Через 27 лет после этого первоначального открытия гелий был обнаружен на Земле - в 1895 году шотландский химик Уильям Рамзай, исследуя образец газа, полученного при разложении минерала клевеита, обнаружил в его спектре ту же ярко-жёлтую линию, найденную ранее в солнечном спектре. Образец был направлен для дополнительного исследования известному английскому учёному-спектроскописту Уильяму Круксу, который подтвердил, что наблюдаемая в спектре образца жёлтая линия совпадает с линией D3 гелия.
23 марта 1895 года Рамзай отправил сообщение о своём открытии гелия на Земле в Лондонское королевское общество, а также во Французскую академию через известного химика Марселена Бертло. так и получилось название этого химического элемента. От греческого наименования Солнца - гелиос. Первое открытие сделанное спектральным методом. Абсорбционная спектроскопия.
Во всех случаях у Рамзая были соавторы: В.Крукс (Англия) - гелий; В. Рэлей (Англия) - аргон; М. Траверс (Англия) - криптон, неон, ксенон.
По 4 элемента обнаружили:
И. Берцелиус (Швеция) - церий, селен, кремний, торий;
Г. Деви (Англия) - калий, кальций, натрий, магний;
П. Лекок де Буабодран (Франция) - галлий, самарий, гадолиний, диспрозий.
На долю России приходится открытие только одного из природных элементов: рутения (44). Название этого элемента происходит от позднелатинского названия России - Ruthenia. Этот элемент открыл профессор Казанского университета Карл Клаус в 1844 году.
Карл-Эрнст Карлович Клаус был русским химиком, автором ряда трудов по химии металлов платиновой группы, первооткрывателем химического элемента рутения. Он родился в 11 (22) января 1796 - 12 (24) марта 1864) в Дерпте, старинном русском городе Юрьеве (ныне Тарту), в семье художника. В 1837 году защитил диссертацию на степень магистра и был назначен адъюнктом по кафедре химии в Казанском университете. С 1839 года стал профессором химии Казанского университета, а с 1852 года – профессором фармации Дерптского университета. В 1861 году стал Членом-корреспондентом Петербургской Академии наук.
То, что большинство известных в природе химических элементов, было открыто учёными Швеции, Англии, Франции и Германии, вполне понятно - в 18-19 веках, когда и были открыты эти элементы, именно в данных странах был наиболее высокий уровень развития химии и химической технологии.
Ещё любопытен вопрос: а женщины-учёные открывали химические элементы?
Да. Но немного. Это Мария Складовская-Кюри, открывшая в 1898 году вместе с мужем П.Кюри полоний (название дано в честь её родины Польши) и радий, Лиза Мейтнер, принимавшая участие в открытии протактиния (1917 год), Ида Ноддак (Такке), обнаружившая в 1925 году совместно с будущим мужем В.Ноддаком рений, и Маргарита Перей, которая в 1939 году открыла франций и стала первой женщиной, избранной во Французскую академию наук.
В современной таблице Менделеева имеется несколько элементов, помимо рутения, названия которых связанны с Россией: самарий (63) - от названия минерала самарскита, открытого русским горным инженером В.М.Самарским в Ильменских горах, менделеевий (101); дубний (105). История названия этого элемента любопытна. Впервые этот элемент был получен на ускорителе в Дубне в 1970 году группой Г.Н.Флёрова путём бомбардировки ядер 243Am ионами 22Ne и независимо в Беркли (США) в ядерной реакции 249Cf + 15N = 260Db + 4n.
Советские исследователи предложили назвать новый элемент нильсборием (Ns), в честь великого датского учёного Нильса Бора, американцы - ганием (Ha), в честь Отто Гана, одного из авторов открытия спонтанного деления урана.
Рабочая группа ИЮПАК в 1993 году сделала вывод, что честь открытия элемента 105 должна быть разделена между группами из Дубны и Беркли. Комиссия ИЮПАК в 1994 году предложила название жолиотий (Jl), в честь Жолио-Кюри. До этого элемент официально назывался латинским числительным - уннилпентиумом (Unp), то есть просто 105-м элементом. Символы Ns, На, Jl можно и сейчас видеть в таблицах элементов, изданных в прежние годы. Например, на ЕГЭ по химии 2013 года. Согласно окончательному решению ИЮПАК в 1997 году этот элемент получил название "дубний" - в честь российского центра по исследованиям в области ядерной физики, наукограда Дубны.
В Объединенном институте ядерных исследований Дубны в разное время были впервые синтезированы сверхтяжелые химические элементы с порядковыми номерами 113–118. Элемент под номером 114 был назван "флеровий" - в честь Лаборатории ядерных реакций им. Г.Н.Флёрова Объединённого института ядерных исследований, где и был синтезирован этот элемент.
За последние 50 лет Периодическая система Д.И. Менделеева пополнилась 17 новыми элементами (102–118), из которых в ОИЯИ синтезировано 9. В том числе в последние 10 лет – 5 наиболее тяжелых (сверхтяжелых) элементов, замыкающих периодическую таблицу…
Впервые 114-й элемент - с "магическим" числом протонов (магические числа - ряд натуральных чётных чисел, соответствующих количеству нуклонов в атомном ядре, при котором становится полностью заполненной какая-либо его оболочка: 2, 8, 20, 28, 50, 82, 126 (последнее число - только для нейтронов) - был получен группой физиков под руководством Ю.Ц.Оганесяна в Объединённом институте ядерных исследований (Дубна, Россия) с участием учёных из Ливерморской национальной лаборатории (Ливермор, США; коллаборацией Дубна-Ливермор) в декабре 1998 года путём синтеза изотопов этого элемента посредством реакции слияния ядер кальция с ядрами плутония. Название 114-го элемента было утверждено 30 мая 2012 года: "флеровий" (Flerovium) и символическое обозначение Fl. Тогда же был назван 116 элемент – "ливерморий" (Livermorium) – Lv (кстати, время жизни этого элемента – 50 миллисекунд).
В настоящее время синтез трансурановых элементов в основном проводится в четырех странах: США, России, Германии и Японии. В России новые элементы получают в Объединенном институте ядерных исследований (ОИЯИ) в Дубне, в США - в Национальной лаборатории Оук-Ридж в Теннеси и Национальной лаборатории Лоуренса в Ливерморе, в Германии - в Центре по изучению тяжелых ионов Гельмгольца (он же - Институт тяжелых ионов) в Дармштадте, в Японии - в Институте физико-химических исследований (RIKEN).
За авторство создания 113-го элемента давно шла борьба между Японией и российско-американской группой ученых. Японские ученые во главе с Косукэ Моритой синтезировали 113-й элемент в сентябре 2004 года, разогнав на ускорителе и столкнув цинк-30 и висмут-83. Им удалось зафиксировать три цепочки распада, соответствующие цепочкам рождения 113-го элемента в 2004, 2005 и 2012 годах.
Российские и американские ученые объявили о создании 113-го элемента в процессе синтеза 115-го элемента в Дубне в феврале 2004 года и предложили назвать его беккерелием. По имени выдающегося физика Антуана Анри Беккереляя (фр. Antoine Henri Becquerel; 15 декабря 1852 - 25 августа 1908) - французский физик, лауреат Нобелевской премии по физике и один из первооткрывателей радиоактивности.
Наконец, в начале 2016 года в периодическую таблицу Менделеева официально добавлены названия четырёх новых химических элементов. Элементы с атомными номерами 113, 115, 117 и 118 верифицированы Международным союзом теоретической и прикладной химии (IUPAC).
Честь открытия 115-го, 117-го и 118-го элементов присуждена команде российских и американских ученых из Объединенного института ядерных исследований в Дубне, Ливерморской национальной лаборатории в Калифорнии и Окриджской национальной лаборатории в Теннесси.
До последнего времени эти элементы (113, 115, 117 и 118) носили не самые звучные названия унунтрий (Uut), унунпентий (Uup), унунсептий (Uus) и унуноктий (Uuo), однако в течение ближайших пяти месяцев первооткрыватели элементов смогут дать им новые, окончательные имена.
Открывателями 113-го элемента официально признаны ученые из японского Института естественных наук (RIKEN). В честь этого элемент рекомендовали назвать "японием". Право придумать названия остальным новым элементам предоставлено первооткрывателям, на что им отводилось пять месяцев, после чего их официально утвердит совет IUPAC.
115-й элемент предложено назвать "московием" в честь Подмосковья!
Свершилось! 8 июня 2016 года Международный союз теоретической и прикладной химии озвучил рекомендованные названия для 113-го, 115-го, 117-го и 118-го элементов таблицы Менделеева. Об этом сообщается на сайте союза.
Один из новых сверхтяжелых элементов таблицы Менделеева за номером 113 официально получил название "нихоний" и символ Nh. Соответствующее объявление сделал японский институт естественных наук "Рикэн", специалисты которого ранее открыли этот элемент.
Слово "нихоний" является производным от местного названия страны - "Нихон".
Международный союз теоретической и прикладной химии утвердил названия новым элементом за номерами 113, 115, 117 и 118 - нихоний(Nh), московий (Mc), тенессин (Ts) и оганессон (Og).
113-й элемент назван в честь Японии, 115-й - в честь Московской области, 117-й - по названию американского штата Теннеси, 118-й - в честь российского ученого академика РАН Юрия Оганесяна.
История открытия Закона Менделеева
Основополагающий шаг в науке о химических превращениях веществ в природе сделал Дмитрий Иванович Менделеев. В третьем томе "Журнала Русского физико-химического общества" в 1871 году была опубликована статья "Естественная система элементов и применение её к указанию свойств некоторых элементов". Эта статья была великим научным предвидением. Автор писал, какие должны быть открыты химические элементы и описывал свойства этих простых тел. Всё к новым открытиям приводили поиски простых тел природы. Люди ещё с незапамятных времён знали о золоте, олове, меди и железе, позже стали известны серебро, свинец, ртуть и сера. К концу XVII века уже было известно почти пятнадцать веществ, которые считались неразложимыми, а в начале XIX века химиками были открыты калий, натрий, барий, кальций и магний.Исследователи изучают свойства новых найденных элементов, определяют их атомные массы, сравнивают насколько он тяжелее или легче уже известных. Водород – самый лёгкий химический элемент, он был принят за единицу измерения, атомный вес водорода стали считать равным 1. Были установлены единые для всех стран химические обозначения – знаки химических элементов.
Ко второй половине XIX века были изучены свойства известных к тому времени элементов и свойства их многочисленных соединений. Во всех химических соединениях надо было разобраться и свести их в единую стройную систему. Такую систему дал науке Менделеев.
Первоначальные наброски периодической системы химических элементов найденные в архиве учёного показывают, что великий закон был открыт в результате упорного, многолетнего труда, на основе огромных знаний. Стараясь установить связь между элементами с резко различными свойствами, Менделеев приходит к убеждению, что количественная характеристика элемента, общая всем веществам, – его атомный вес – должна быть связана с качеством вещества, с его свойствами. "Меня неоднократно спрашивали, – пишет он, – на основании чего, исходя из какой мысли, найден был мною и упорно защищаем периодический закон? Приведу... свой посильный ответ... Посвятив свои силы изучению вещества, я вижу в нём два таких признака или свойства: массу, занимающую пространство и проявляющуюся в притяжении, а яснее или реальнее всего в весе, и индивидуальность, выраженную в химических превращениях, а яснее всего формулированную в представлении о химических элементах... невольно зарождается мысль о том, что между массою и химическими элементами необходимо должна быть связь, а так как масса вещества, хотя и не абсолютная, а лишь относительная, выражается окончательно в виде атомов, то надо искать... соответствия между индивидуальными свойствами элементов и их атомными весами".
Основная идея, которой руководствовался Менделеев в своём открытии, заключалась в установлении связи между элементами с резко различными свойствами. "В сопоставлении несходных элементов заключается, по - моему, основной признак, отличающий мою систему от систем моих предшественников" – писал в 1871 году в статье, помещённой и журнале "Русского физико-химического общества", автор великого закона.
Великий химик сопоставил две несходные группы химических элементов – группу галогенов, к которой относятся хлор, бром, фтор и йод, и группу щелочных металлов – лития, калия, натрия, магния, кальция, стронция, бария. И это определило успех открытия.
Ключом к решению многих задач науки является периодический закон. Найдя периодическую зависимость свойств элементов от их места в таблице и от их атомного веса, можно строго научно предсказать, какие элементы должны ещё существовать в природе и даже какие свойства этих ещё не открытых веществ.
Менделеев предсказал открытие химических элементов, по своим свойствам похожих на кремний, алюминий и бор. Он описал подробно химические и физические свойства этих ещё никому не известных элементов, а через 20 лет все три предсказанных элемента были открыты и все свойства открытых элементов оказались такими, как предсказал Менделеев. Важнейший этап в многовековой борьбе за познание основ нашего мира, за освобождение науки от идеалистических, религиозных взглядов прошлых веков, заканчивается утверждением закона Менделеева.
Д. И. Менделеев даёт новое представление о химических элементах, об их взаимосвязи и взаимозависимости. Химические элементы составляют одну большую семью и в периодической системе каждому химическому элементу соответствует определённое место. Мировоззренческое значение периодического закона состоит в том, что он объединяет все химические элементы как ступени развития единой материи.
Разбитые на группы и периоды, химические элементы показывают своё родство и при этом видно развитие каждого более лёгкого элемента, заключенного в первом периоде таблицы, в более тяжёлый и сложно устроенный элемент. Из таких же химических элементов – основ мироздания – строятся все другие тела природы и это значит, что жизнь так же материальна, как и всё существующее вокруг нас.
Закон Менделеева действует не только на Земле. Метеориты падающие на землю, состоят из тех же химических элементов, которые объединены таблице Менделеева. В составе Солнца учёным удалось обнаружить больше шестидесяти химических элементов, и все они находятся в таблице Менделеева.
Периодический закон имел и имеет большое значение для развития естествознания. Он является могучим орудием познания природы, её закономерностей. Когда были открыты радиоактивные химические элементы, их изучению помог закон Менделеева. Понять и изучить свойства новых элементов позволила периодическая система. Руководствуясь законом Менделеева, учёные успешно раскрыли строение атома и научились освобождать энергию его недр.
Химический элемент таблицы Менделеева
Человек и всё, что его окружает образовано из химических элементов. И что же такое химический элемент? Это понятие сформировалось в XVIII веке, когда химия делала свои первые шаги. Понятие атома впервые появилось у философа Левкиппа, а теорию развил его ученик Демокрит. Учёные считали, что в мире всё состоит из невидимых глазом частиц, которые соединяются и разъединяются, порождая все видимые вещи. Впервые суть атомистической теории была описана древнеримским философом Лукрецием. А потом была забыта почти на два тысячелетия. На научной основе возродил теорию английский химик Джон Дальтон (1766 - 1844). У Дальтона каждому элементу соответствовал свой сорт атомов - со своей массой и свойствами, а первые эксперименты позволили определить относительные атомные массы ряда химических элементов. В статьях Дальтон изображал различные элементы как изобретёнными значками, так и алхимическими символами. Известен Дальтон и тем, что описал цветовую слепоту, которую назвал дальтонизмом.Определение химического элемента закрепилось после 1750 гг., которое также упоминалось и в работах известного французского химика Антуана Лорана Лавуазье (1743 - 1794): "Любые неразложенные вещества являются элементами". Современное название химического элемента - это совокупность атомов одного сорта. Это абстрактное понятие, его нельзя увидеть, в отличие от простого вещества. Можно из нескольких атомов химического элемента углерода получить кристалл алмаза или подобные простые вещества, например, графит, графен, нанотрубки и пр. Как правило, из большинства химических элементов можно создать различные простые вещества. Различие будет или в числе атомов молекул или в расположении атомов в веществе. Сложные вещества - это вещества полученные из атомов различных элементов. Долгое время воду считали простым веществом, пока её не разложили и получили одновременно водород и кислород. Это послужило доказательством того, что вода является сложным веществом.
Структура таблицы Менделеева
В Периодической таблице следующие за группой марганца девять элементов рассматривают "по горизонтали" и называют их триадами, в них входят элементы, которые имеют близкие физические и химические свойства. Шесть элементов в двух триадах (рутений Ru, родий Rh, палладий Pd, осмий Os, иридий Ir и платина Pt) объединяют названием "платиновые металлы" или металлы платиновой группы. Д. И. Менделеев писал, "...атомные весы Fe, Co и Ni, Ru, Rh и Pd, Os, Ir и Pt очень близки между собою, но и свойства их очень близки, различия иногда едва уловимы... Шесть металлов: рутений Ru, родий Rh, палладий Pd, осмий Os, иридий Ir и платина Pt встречаются вместе в природе всегда с преобладанием платины, отчего и называются платиновыми металлами... Эти металлы встречаются в природе почти исключительно в самородном состоянии".Периодическая система - упорядоченное множество химических элементов, их естественная классификация, которая является графическим (табличным) выражением периодического закона химических элементов. Структура её, во многом сходная с современной, разработана Д. И. Менделеевым на основе периодического закона в 1869–1871 гг.
Прообразом периодической системы был «Опыт системы элементов, основанной на их атомном весе и химическом сходстве», составленный Д. И. Менделеевым 1 марта 1869 г. На протяжении двух с половиной лет ученый непрерывно совершенствовал «Опыт системы», ввел представление о группах, рядах и периодах элементов. В результате структура периодической системы приобрела во многом современные очертания.
Важным для её эволюции стало понятие о месте элемента в системе, определяемом номерами группы и периода. Опираясь на это понятие, Менделеев пришел к выводу, что необходимо изменить атомные массы некоторых элементов: урана, индия, церия и его спутников. Это было первое практическое применение периодической системы. Менделеев также впервые предсказал существование и свойства нескольких неизвестных элементов. Ученый подробно описал важнейшие свойства экаалюминия (будущего галлия), экабора (скандия) и экасилиция (германия). Кроме того, он предсказал существование аналогов марганца (будущих технеция и рения), теллура (полония), иода (астата), цезия (франция), бария (радия), тантала (протактиния). Прогнозы ученого в отношении данных элементов носили общий характер, поскольку эти элементы располагались в малоизученных областях периодической системы.
Первые варианты периодической системы во многом представляли лишь эмпирическое обобщение. Ведь был неясен физический смысл периодического закона, отсутствовало объяснение причин периодического изменения свойств элементов в зависимости от возрастания атомных масс. В связи с этим оставались нерешенными многие проблемы. Есть ли границы периодической системы? Можно ли определить точное количество существующих элементов? Оставалась неясной структура шестого периода - каково точное количество редкоземельных элементов? Было неизвестно, существуют ли еще элементы между водородом и литием, какова структура первого периода. Поэтому вплоть до физического обоснования периодического закона и разработки теории периодической системы перед ней не раз возникали серьезные трудности. Неожиданным было открытие в 1894–1898 гг. пяти инертных газов, которым, казалось, не находилось места в периодической системе. Эта трудность была устранена благодаря идее включить в структуру периодической системы самостоятельную нулевую группу. Массовое открытие радиоэлементов на стыке XIX и XX вв. (к 1910 г. их число составило около 40) привело к резкому противоречию между необходимостью их размещения в периодической системе и её сложившейся структурой. Для них было только 7 вакантных мест в шестом и седьмом периодах. Эта проблема была решена в результате установления правил сдвига и открытия изотопов.
Одна из главных причин невозможности объяснить физический смысл периодического закона и структуру периодической системы состояла в том, что было неизвестно, как устроен атом (см. Атом). Важнейшей вехой на пути развития периодической системы явилось создание атомной модели Э. Резерфордом (1911). На её основе голландский ученый А. Ван ден Брук (1913) высказал предположение, что порядковый номер элемента в периодической системе численно равен заряду ядра его атома (Z). Это экспериментально подтвердил английский ученый Г. Мозли (1913). Периодический закон получил физическое обоснование: периодичность изменения свойств элементов стала рассматриваться в зависимости от Z - заряда ядра атома элемента, а не от атомной массы (см. Периодический закон химических элементов).
В результате структура периодической системы значительно упрочилась. Была определена нижняя граница системы. Это водород - элемент с минимальным Z = 1. Стало возможным точно оценить количество элементов между водородом и ураном. Были определены «пробелы» в периодической системе, соответствующие неизвестным элементам с Z = 43, 61, 72, 75, 85, 87. Однако оставались неясными вопросы о точном количестве редкоземельных элементов и, что особенно важно, не были вскрыты причины периодичности изменения свойств элементов в зависимости от Z.
Опираясь на сложившуюся структуру периодической системы и результаты изучения атомных спектров, датский ученый Н. Бор в 1918–1921 гг. развил представления о последовательности построения электронных оболочек и подоболочек в атомах. Ученый пришел к выводу, что сходные типы электронных конфигураций внешних оболочек атомов периодически повторяются. Таким образом, было показано, что периодичность изменения свойств химических элементов объясняется существованием периодичности в построении электронных оболочек и подоболочек атомов.
Периодическая система охватывает более 100 элементов. Из них все трансурановые элементы (Z = 93–110), а также элементы с Z = 43 (технеций), 61 (прометий), 85 (астат), 87 (франций) получены искусственно. За всю историю существования периодической системы было предложено очень большое количество (>500) вариантов её графического изображения, преимущественно в виде таблиц, а также в виде различных геометрических фигур (пространственных и плоскостных), аналитических кривых (спиралей и пр.) и т. д. Наибольшее распространение получили короткая, полудлинная, длинная и лестничная формы таблиц. В настоящее время предпочтение отдается короткой форме.
Фундаментальным принципом построения периодической системы является её подразделение на группы и периоды. Менделеевское понятие рядов элементов ныне не употребляется, поскольку лишено физического смысла. Группы, в свою очередь, подразделяются на главную (а) и побочную (Ь) подгруппы. В каждой подгруппе содержатся элементы - химические аналоги. Элементы a‑ и b‑подгрупп в большинстве групп также обнаруживают между собой определенное сходство, главным образом в высших степенях окисления, которые, как правило, равны номеру группы. Периодом называется совокупность элементов, которая начинается щелочным металлом и заканчивается инертным газом (особый случай - первый период). Каждый период содержит строго определенное количество элементов. Периодическая система состоит из восьми групп и семи периодов, причем седьмой период пока не завершен.
Особенность первого периода заключается в том, что он содержит всего 2 газообразных в свободном виде элемента: водород и гелий. Место водорода в системе неоднозначно. Поскольку он проявляет свойства, общие со щелочными металлами и с галогенами, то его помещают либо в 1a‑, либо в Vlla‑подгруппу, либо в обе одновременно, заключая в одной из подгрупп символ в скобки. Гелий - первый представитель VIIIa‑подгруппы. Долгое время гелий и все инертные газы выделяли в самостоятельную нулевую группу. Это положение потребовало пересмотра после синтеза химических соединений криптона, ксенона и радона. В результате инертные газы и элементы бывшей VIII группы (железо, кобальт, никель и платиновые металлы) были объединены в рамках одной группы.
Второй период содержит 8 элементов. Он начинается щелочным металлом литием, единственная степень окисления которого +1. Далее следует бериллий (металл, степень окисления +2). Бор проявляет уже слабо выраженный металлический характер и является неметаллом (степень окисления +3). Следующий за бором углерод - типичный неметалл, который проявляет степени окисления как +4, так и −4. Азот, кислород, фтор и неон - все неметаллы, причем у азота высшая степень окисления +5 соответствует номеру группы. Кислород и фтор относятся к самым активным неметаллам. Инертный газ неон завершает период.
Третий период (натрий - аргон) также содержит 8 элементов. Характер изменения их свойств во многом аналогичен тому, который наблюдался для элементов второго периода. Но здесь есть и своя специфика. Так, магний в отличие от бериллия более металличен, так же как и алюминий по сравнению с бором. Кремний, фосфор, сера, хлор, аргон - все это типичные неметаллы. И все они, кроме аргона, проявляют высшие степени окисления, равные номеру группы.
Как видим, в обоих периодах по мере увеличения Z наблюдается отчетливое ослабление металлических и усиление неметаллических свойств элементов. Д. И. Менделеев называл элементы второго и третьего периодов (по его словам, малых) типическими. Элементы малых периодов принадлежат к числу самых распространенных в природе. Углерод, азот и кислород (наряду с водородом) - органогены, т. е. основные элементы органической материи.
Все элементы первого - третьего периодов размещаются в a‑подгруппах.
Четвертый период (калий - криптон) содержит 18 элементов. По Менделееву, это первый большой период. После щелочного металла калия и щелочноземельного металла кальция следует ряд элементов, состоящий из 10 так называемых переходных металлов (скандий - цинк). Все они входят в b‑подгруппы. Большинство переходных металлов проявляют высшие степени окисления, равные номеру группы, кроме железа, кобальта и никеля. Элементы, начиная с галлия и кончая криптоном, принадлежат к а-подгруппам. Для криптона известен ряд химических соединений.
Пятый период (рубидий - ксенон) по своему построению аналогичен четвертому. В нем также содержится вставка из 10 переходных металлов (иттрий - кадмий). У элементов этого периода есть свои особенности. В триаде рутений - родий - палладий для рутения известны соединения, где он проявляет степень окисления +8. Все элементы a‑подгрупп проявляют высшие степени окисления, равные номеру группы. Особенности изменения свойств у элементов четвертого и пятого периодов по мере роста Z имеют по сравнению со вторым и третьим периодами более сложный характер.
Шестой период (цезий - радон) включает 32 элемента. В этом периоде кроме 10 переходных металлов (лантан, гафний - ртуть) содержится еще и совокупность из 14 лантаноидов - от церия до лютеция. Элементы от церия до лютеция химически очень похожи, и на этом основании их давно включают в семейство редкоземельных элементов. В короткой форме периодической системы ряд лантаноидов включают в клетку лантана и расшифровку этого ряда дают внизу таблицы (см. Лантаноиды).
В чем состоит специфика элементов шестого периода? В триаде осмий - иридий - платина для осмия известна степень окисления +8. Астат имеет достаточно выраженный металлический характер. Радон обладает наибольшей реакционной способностью из всех инертных газов. К сожалению, из‑за того, что он сильно радиоактивен, его химия мало изучена (см. Радиоактивные элементы).
Седьмой период начинается с франция. Подобно шестому, он также должен содержать 32 элемента, но из них пока известны 24. Франций и радий соответственно являются элементами Ia‑ и IIa‑подгрупп, актиний принадлежит к IIIb‑подгруппе. Далее следует семейство актиноидов, которое включает элементы от тория до лоуренсия и размещается аналогично лантаноидам. Расшифровка этого ряда элементов также дается внизу таблицы.
Теперь посмотрим, как изменяются свойства химических элементов в подгруппах периодической системы. Основная закономерность этого изменения заключается в усилении металлического характера элементов по мере роста Z. Особенно отчетливо эта закономерность проявляется в IIIa–VIIa‑подгруппах. Для металлов Ia–IIIa‑подгрупп наблюдается рост химической активности. У элементов IVa–VIIa‑подгрупп по мере увеличения Z наблюдается ослабление химической активности элементов. У элементов b‑подгрупп характер изменения химической активности более сложен.
Теория периодической системы была разработана Н. Бором и другими учеными в 20‑х гг. XX в. и основана на реальной схеме формирования электронных конфигураций атомов (см. Атом). Согласно этой теории, по мере роста Z заполнение электронных оболочек и подоболочек в атомах элементов, входящих в периоды периодической системы, происходит в следующей последовательности:
| Номера периодов | ||||||
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 1s | 2s2p | 3s3p | 4s3d4p | 5s4d5p | 6s4f5d6p | 7s5f6d7p |
На основании теории периодической системы можно дать следующее определение периода: период есть совокупность элементов, начинающаяся элементом со значением n, равным номеру периода, и l = 0 (s‑элементы) и заканчивающаяся элементом с тем же значением n и l = 1 (p‑элементы) (см. Атом). Исключение составляет первый период, содержащий только 1s‑элементы. Из теории периодической системы следуют числа элементов в периодах: 2, 8, 8, 18, 18, 32…
В таблице символы элементов каждого типа (s‑, p‑, d‑ и f‑элементы) изображены на определенном цветовом фоне: s‑элементы - на красном, p‑элементы - на оранжевом, d‑элементы - на синем, f‑элементы - на зеленом. В каждой клетке приведены порядковые номера и атомные массы элементов, а также электронные конфигурации внешних электронных оболочек.
Из теории периодической системы следует, что к a‑подгруппам принадлежат элементы с n, равным номеру периода, и l = 0 и 1. К b‑подгруппам относятся те элементы, в атомах которых происходит достройка оболочек, ранее остававшихся незавершенными. Именно поэтому первый, второй и третий периоды не содержат элементов b‑подгрупп.
Структура периодической системы элементов тесно связана со строением атомов химических элементов. По мере роста Z периодически повторяются сходные типы конфигурации внешних электронных оболочек. А именно они определяют основные особенности химического поведения элементов. Эти особенности по‑разному проявляются для элементов a‑подгрупп (s‑ и р‑элементы), для элементов b‑подгрупп (переходные d‑элементы) и элементов f‑семейств - лантаноидов и актиноидов. Особый случай представляют элементы первого периода - водород и гелий. Для водорода характерна высокая химическая активность, потому что его единственный 1s‑электрон легко отщепляется. В то же время конфигурация гелия (1s 2) весьма устойчива, что обусловливает его химическую бездеятельность.
У элементов а-подгрупп происходит заполнение внешних электронных оболочек атомов (с n, равным номеру периода), поэтому свойства этих элементов заметно изменяются по мере роста Z. Так, во втором периоде литий (конфигурация 2s) - активный металл, легко теряющий единственный валентный электрон; бериллий (2s 2) - также металл, но менее активный вследствие того, что его внешние электроны более прочно связаны с ядром. Далее, бор (2s 2 p) имеет слабо выраженный металлический характер, а все последующие элементы второго периода, у которых происходит построение 2p‑подоболочки, являются уже неметаллами. Восьмиэлектронная конфигурация внешней электронной оболочки неона (2s 2 p 6) - инертного газа - очень прочна.
Химические свойства элементов второго периода объясняются стремлением их атомов приобрести электронную конфигурацию ближайшего инертного газа (конфигурацию гелия - для элементов от лития до углерода или конфигурацию неона - для элементов от углерода до фтора). Вот почему, например, кислород не может проявлять высшей степени окисления, равной номеру группы: ведь ему легче достичь конфигурации неона путем приобретения дополнительных электронов. Такой же характер изменения свойств проявляется у элементов третьего периода и у s‑ и p‑элементов всех последующих периодов. В то же время ослабление прочности связи внешних электронов с ядром в a‑подгруппах по мере роста Z проявляется в свойствах соответствующих элементов. Так, для s‑элементов отмечается заметный рост химической активности по мере роста Z, а для p‑элементов - нарастание металлических свойств.
В атомах переходных d‑элементов достраиваются не завершенные ранее оболочки со значением главного квантового числа n, на единицу меньшим номера периода. За отдельными исключениями, конфигурация внешних электронных оболочек атомов переходных элементов - ns 2 . Поэтому все d‑элементы являются металлами, и именно поэтому изменения свойств d‑элементов по мере роста Z не так резки, как это наблюдается у s‑ и p‑элементов. В высших степенях окисления d‑элементы проявляют определенное сходство с p‑элементами соответствующих групп периодической системы.
Особенности свойств элементов триад (VIIIb‑подгруппа) объясняются тем, что b‑подоболочки близки к завершению. Вот почему железо, кобальт, никель и платиновые металлы, как правило, не склонны давать соединения высших степеней окисления. Исключение составляют лишь рутений и осмий, дающие оксиды RuO 4 и OsO 4 . У элементов Ib‑ и IIb‑подгрупп d‑подоболочка фактически оказывается завершенной. Поэтому они проявляют степени окисления, равные номеру группы.
В атомах лантаноидов и актиноидов (все они металлы) происходит достройка ранее не завершенных электронных оболочек со значением главного квантового числа n на две единицы меньше номера периода. В атомах этих элементов конфигурация внешней электронной оболочки (ns 2) сохраняется неизменной, а заполняется третья снаружи N‑оболочка 4f‑электронами. Вот почему лантаноиды так сходны.
У актиноидов дело обстоит сложнее. В атомах элементов с Z = 90–95 электроны 6d и 5f могут принимать участие в химических взаимодействиях. Поэтому актиноиды имеют гораздо больше степеней окисления. Например, для нептуния, плутония и америция известны соединения, где эти элементы выступают в семивалентном состоянии. Только у элементов, начиная с кюрия (Z = 96), становится устойчивым трехвалентное состояние, но и здесь есть свои особенности. Таким образом, свойства актиноидов значительно отличаются от свойств лантаноидов, и оба семейства поэтому нельзя считать подобными.
Семейство актиноидов заканчивается элементом с Z = 103 (лоуренсий). Оценка химических свойств курчатовия (Z = 104) и нильсбория (Z = 105) показывает, что эти элементы должны быть аналогами соответственно гафния и тантала. Поэтому ученые полагают, что после семейства актиноидов в атомах начинается систематическое заполнение 6d‑подоболочки. Оценка химической природы элементов с Z = 106–110 экспериментально не проводилась.
Конечное число элементов, которое охватывает периодическая система, неизвестно. Проблема её верхней границы - это, пожалуй, основная загадка периодической системы. Наиболее тяжелый элемент, который удалось обнаружить в природе,- это плутоний (Z = 94). Достигнутый предел искусственного ядерного синтеза - элемент с порядковым номером 110. Остается открытым вопрос: удастся ли получить элементы с большими порядковыми номерами, какие и сколько? На него нельзя пока ответить сколь‑либо определенно.
С помощью сложнейших расчетов, выполненных на электронных вычислительных машинах, ученые попытались определить строение атомов и оценить важнейшие свойства «сверхэлементов», вплоть до огромных порядковых номеров (Z = 172 и даже Z = 184). Полученные результаты оказались весьма неожиданными. Например, в атоме элемента с Z = 121 предполагается появление 8p‑электрона; это после того, как в атомах с Z = 119 и 120 завершилось формирование 8s‑подоболочки. А ведь появление p‑электронов вслед за s‑электронами наблюдается только в атомах элементов второго и третьего периодов. Расчеты показывают также, что у элементов гипотетического восьмого периода заполнение электронных оболочек и под-оболочек атомов происходит в очень сложной и своеобразной последовательности. Поэтому оценить свойства соответствующих элементов - проблема весьма сложная. Казалось бы, восьмой период должен содержать 50 элементов (Z = 119–168), но, согласно расчетам, он должен завершаться у элемента с Z = 164, т. е. на 4 порядковых номера раньше. А «экзотический» девятый период, оказывается, должен состоять из 8 элементов. Вот его «электронная» запись: 9s 2 8p 4 9p 2 . Иными словами, он содержал бы всего 8 элементов, как второй и третий периоды.
Трудно сказать, насколько соответствовали бы истине расчеты, проделанные с помощью компьютера. Однако если бы они были подтверждены, то пришлось бы серьезно пересмотреть закономерности, лежащие в основе периодической системы элементов и её структуры.
Периодическая система сыграла и продолжает играть огромную роль в развитии различных областей естествознания. Она явилась важнейшим достижением атомно-молекулярного учения, способствовала появлению современного понятия «химический элемент» и уточнению понятий о простых веществах и соединениях.
Закономерности, вскрытые периодической системой, оказали существенное влияние на разработку теории строения атомов, открытие изотопов, появление представлений о ядерной периодичности. С периодической системой связана строго научная постановка проблемы прогнозирования в химии. Это проявилось в предсказании существования и свойств неизвестных элементов и новых особенностей химического поведения элементов уже открытых. Ныне периодическая система представляет фундамент химии, в первую очередь неорганической, существенно помогая решению задачи химического синтеза веществ с заранее заданными свойствами, разработке новых полупроводниковых материалов, подбору специфических катализаторов для различных химических процессов и т. д. И наконец, периодическая система лежит в основе преподавания химии.
Сергей, видимо Вы молоды и не ощущаете себя частью нашей страны. Понятно, если молоды, но не вызывает уважения, если Вы - "гражданин Москвы".
1. "Как же мне надоели диванные политические эксперты, хвастуны и невоспитанные выскочки, которые уехали жить в другие страны, а теперь при любой возможности пытаются отсыпать "комплиментов" своим бывшим соотечественникам. "
Да хрен с ними, они нас не интересуют у нас свои шкурные интересы - как НАМ жить.. Хоть и жаль потерять таких. Это люди, как минимум, не побоявшиеся сорваться и начать жизнь с чистого листа и низа социальной лестницы.
2. "И агрессии жителей Украины тоже не понимаю. И жителей других стран. Но зачем вымещать злобу на обычных людях вроде наших читателей или вот журналистов нашего портала? Мы вообще никакого отношения ко всему этому не имеем. Сидим тут, спокойно общаемся на околонаучные темы. А вам бы всё про "москалей" зубы поскалить. Самовыражаться можно и в других областях, а не только оскорбляя других людей в Интернете."
Гм... У воспитанных в совке, нормально воспитанных, в подкорке сидит: "Вставай страна огромная..." когда враг входит на нашу землю. Слава аллаху и будде, что хохлы - индивидуалисты и чхать в основном хотели на свою страну. Вот и срут в интернете или обматерят клятого москаля вместо полноценной войны за свой кусок земли... А Вы бы какой вариант предпочли?
3. "То, что происходит между нашими политиками - это одно. " Не надо п....ть!! "Маленькие победоносные войны" на то и рассчитаны, чтобы вызвать патриотический угар у маленьких людей! Поддержка Путина 87% вполне реальна, по крайнее мере до падения рубля! И именно эти 87% ответственны за то, что происходит с остальными 13% и с нашими соседями: "братьями грузинами", "братьями украинцами".
4. Самое главное.
Даже хохлы могут забить болт на потерю части территории, на ущемление эго и яиц. А нам тут жить. И Вы, Сергей, видимо не знаете истории своей семьи, или она стояла в стороне от того, что у нас творилась.
А моя семья в течении многих поколений кровью впаяна в эту землю. Только за 20 век: воевали 6 мужиков в 3 войнах, двое не вернулись. 4 женщин и детей от голода умерли. Раскучивали. В лагерях сгинули 4 человека. Один атомное оружие испытывал, умер от рака. Его сын в 24 года умер из-за последствий облучения отца. Двое ученых в роду, руководители химической и энергетической промышленности, врачи высшей категории, учитель, военнослужащий, штурмовавший дворец Амина.
И ради чего все это?? Люди творили будущее, без дураков не щадя себя и здоровье, или же выживали ради детей. И что мы видим??? Да хрен с ней, с бедностью. Но тотально же губится наследие предков. Где и как наши дети будут жить? Нормой стало кидалово на государственном уровне. По федеральным программам финансирования "Чистая вода" надо налом возвращать до 30%!! Молодежь тупая и безграмотная. Простейший конкурс на считать-писать-физика-математика проходят 0,3-0,7% выпускников технических ВУЗов! Из кого готовить инженеров, ученых-прикладников??
Много ли российских новостей за 2015 год, для нас радостных? Выкинули из очередной международной программы? Очередное "фи" от других стран? Очередной обвал рубля? Очередное сворачивание производства и рынка в целом?
Он опирался на труды Роберта Бойле и Антуана Лавузье. Первый ученый ратовал за поиск неразложимых химических элементов. 15 из таковых Бойле перечислил еще в 1668-ом году.
Лавузье прибавил к ним еще 13, но спустя век. Поиски растянулись, поскольку не было стройной теории связи между элементами. Наконец, в «игру» вступил Дмитрий Менделеев. Он решил, что есть связь между атомной массой веществ и их местом в системе.
Эта теория позволила ученому открыть десятки элементов, не обнаруживая их на практике, а природе. Это было возложено на плечи потомков. Но, сейчас не о них. Посвятим статью великому русскому ученому и его таблице.
История создания таблицы Менделеева
Таблица Менделеева началась с книги «Соотношение свойств с атомным весом элементов». Труд выпущен в 1870-ых. Тогда же русский ученый выступил перед химическим обществом страны и разослал первый вариант таблицы коллегам из-за рубежа.
До Менделеева разными учеными были открыты 63 элемента. Наш соотечественник начал со сравнения их свойств. В первую очередь, работал с калием и хлором. Потом, взялся за группу металлов щелочной группы.
Химик обзавелся специальным столом и карточками элементов, чтобы раскладывать их, как пасьянс, ища нужные совпадения и комбинации. В итоге, пришло прозрение: — свойства компонентов зависят от массы их атомов. Так, элементы таблицы Менделеева выстроились в ряды.
Находкой маэстро химии стало решение оставить в этих рядах пустоты. Периодичность перепада между атомными массами заставила ученого предположить, что человечеству известны еще не все элементы. Промежутки в весе между некоторыми «соседями» были слишком велики.

Поэтому, периодическая таблица Менделеева стала похожа на шахматное поле, с обилием «белых» клеток. Время показало, что они, действительно, ждали своих «постояльцев». Ими, к примеру, стали инертные газы. Гелий, неон, аргон, криптон, радиоакт и ксенон открыты лишь в 30-ых годах 20-го века.
Теперь о мифах. Распространено мнение, что химическая таблица Менделеева явилась ему во сне. Это происки университетских педагогов, точнее, одного из них – Александра Иностранцева. Это русский геолог, читавший лекции в Петербургском университете горного дела.
Иностранцев был знаком с Менделеевым, бывал у него в гостях. Однажды, изможденный поисками Дмитрий заснул прямо при Александе. Тот дождался, пока химик проснется и увидел, как Менделеев хватается за листок и записывает окончательный вариант таблицы.
По сути, ученый просто не успел сделать это до того, как его захватил Морфей. Однако, Иностранцеву хотелось позабавить своих студентов. На основе виденного геолог придумал байку, которую благодарные слушатели быстро распространили в массы.
Особенности таблицы Менделеева
С момента первой версии 1969-го года порядковая таблица Менделеева не раз дорабатывалась. Так, с открытием в 1930-ых благородных газов удалось вывести новую зависимость элементов, — от их порядковых номеров, а не массы, как заявлял автор системы.
Понятие «атомный вес» заменили на «атомный номер». Удалось изучить число протонов в ядрах атомов. Эта цифра и есть порядковый номер элемента.
Ученые 20-го века изучили и электронное строение атомов. Оно тоже влияет на периодичность элементов и отражено в поздних редакциях таблицы Менделеева. Фото списка демонстрирует, что вещества в нем расставлены по мере роста атомного веса.
Первооснову менять не стали. Масса увеличивается слева направо. При этом, таблица не едина, а поделена на 7 периоды. Отсюда и название списка. Период – горизонтальный ряд. Его начало – типичные металлы, конец – элементы с неметаллическими свойствами. Убывание постепенное.
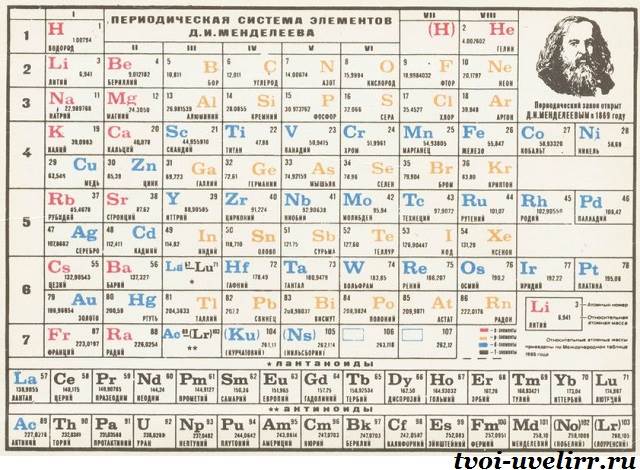
Есть большие и малые периоды. Первые находятся в начале таблицы, их 3. Открывает список период из 2-х элементов. Следом идут две колонки, в которых по 8 наименований. Оставшиеся 4 периода большие. Наиболее протяжен 6-ой, в нем 32 элемента. В 4-ом и 5-ом их по 18, а в 7-ом – 24.
Можно сосчитать, сколько элементов в таблице Менделеева. Всего 112 наименований. Именно наименований. Клеток же 118, а есть вариации списка и со 126-ю полями. Все еще остаются пустые клетки для неоткрытых элементов, не имеющих имен.
Не все периоды умещаются в одну строку. Большие периоды состоят из 2-х рядов. Количество металлов в них перевешивает. Поэтому, им полностью посвящены нижние строки. Постепенное убывание от металлов к инертным веществам соблюдается в верхних рядах.
Картинки таблицы Менделеева поделены и вертикально. Это группы в таблице Менделеева , их 8. Вертикально скомпонованы элементы, схожие по химическим свойствам. Они поделены на главную и побочную подгруппы. Последние начинаются только с 4-го периода. В главные подгруппы входят и элементы малых периодов.
Суть таблицы Менделеева
Названия элементов в таблице Менделеева – это 112 позиций. Суть их компоновки в единый список – систематизация первоэлементов. Над этим начали биться еще в античные времена.
Одним из первых понять, из чего составлено все сущее попытался Аристотель. Он взял за основу свойства веществ – холод и тепло. Эмпидокл выделил 4-ре первоосновы по стихиям: воду, землю, огонь и воздух.
Металлы в таблице Менделеева , как и другие элементы, — те самые первоосновы, но с современной точки зрения. Российскому химику удалось открыть большинство составляющих нашего мира и предположить существование еще неизвестных первоэлементов.

Получается, что произношение таблицы Менделеева – озвучивание некой модели нашей реальности, раскладывание ее на составляющие. Однако, выучить их не так-то просто. Попробуем облегчить задачу, описав пару эффективных методов.
Как выучить таблицу Менделеева
Начнем с современного метода. Компьютерщиками разработан ряд флеш-игр, помогающих запомнить список Менделеева. Участникам проекта предлагают находить элементы по разным опциям, например, названию, атомной массе, буквенному обозначению.
Игрок имеет право выбрать поле деятельности – лишь часть таблицы, или ее всю. В нашей воле, так же, исключить имена элементов, другие параметры. Это усложняет поиск. Для продвинутых предусмотрен и таймер, то есть тренировка ведется на скорость.
Игровые условия делают изучение номеров элементов в таблице Менднлеева не нудным, а занятным. Просыпается азарт, и систематизировать знания в голове становится проще. Те же, кто не приемлет компьютерных флеш-проектов, предлагают более традиционный способ заучивания списка.
Его делят на 8 групп, или 18 (в соответствии с редакцией 1989-го года). Для удобства запоминания, лучше создать несколько отдельных таблиц, а не работать по цельному варианту. Помогают и зрительные образы, подобранные к каждому из элементов. Опираться следует на собственные ассоциации.
Так, железо в мозгу может соотноситься, к примеру, с гвоздем, а ртуть – с градусником. Название элемента незнакомо? Пользуемся методом наводящих ассоциаций. , например, составим из начал слов «ириска» и «динамик».
Характеристика таблицы Менделеева не учиться в один присест. Рекомендованы занятия по 10-20 минут в день. Начинать рекомендована с запоминания лишь основных характеристик: названия элемента, его обозначения, атомной массы и порядкового номера.
Школьники предпочитают вешать таблицу Менделеева над рабочим столом, или на стене, на которую часто смотрят. Метод хорош для людей с преобладанием зрительной памяти. Данные из списка невольно запоминаются даже без зубрежки.
Это учитывают и педагоги. Как правило, они не заставляют заучивать список, разрешают смотреть в него даже на контрольных. Постоянное заглядывание в таблицу равнозначно эффекту распечатки на стене, или написанию шпаргалок до экзаменов.
Приступая к изучению, вспомним, что и Менделеев не сразу запомнил свой список. Однажды, когда ученого спросили, как он открыл таблицу, последовал ответ: — «Я над ней, может, 20 лет думал, а вы считаете: сидел и, вдруг, готово». Периодическая система – кропотливый труд, который не осилить в сжатые сроки.

Наука не терпит спешки, ведь она приводит к заблуждениям и досадным ошибкам. Так, одновременно с Менделеевым таблицу составил и Лотар Мейер. Однако, немец немного недоработал список и не был убедителен при доказательстве своей точки зрения. Поэтому, общественность признала труд русского ученого, а не его коллеги-химика из Германии.
