ตารางธาตุของระบบธาตุ ฮาโลเจนและก๊าซมีตระกูล
คำแนะนำ
ระบบเป็นระยะคือ "บ้าน" หลายชั้นที่มีอพาร์ทเมนท์จำนวนมาก “ผู้เช่า” หรือองค์ประกอบทางเคมีแต่ละรายอาศัยอยู่ในอพาร์ตเมนต์ของตนเองตามจำนวนที่กำหนด ซึ่งเป็นจำนวนถาวร นอกจากนี้ธาตุยังมี “นามสกุล” หรือชื่อ เช่น ออกซิเจน โบรอน หรือไนโตรเจน นอกเหนือจากข้อมูลนี้ แต่ละ “อพาร์ตเมนต์” หรือเซลล์ยังมีข้อมูล เช่น มวลอะตอมสัมพัทธ์ ซึ่งอาจมีค่าที่แน่นอนหรือปัดเศษก็ได้
ผลรบกวนของสัมพัทธภาพ
หากมีการสังเคราะห์องค์ประกอบเพิ่มเติม องค์ประกอบเหล่านั้นก็จะอยู่ในชุดข้อมูลใหม่ของระบบ มีจำนวนเก้าตัว พวกมันมีที่ว่างสำหรับอิเล็กตรอนอีกสองตัวเหมือนเมื่อก่อน ดังนั้นโดยรวมแล้วคาบจะยาวขึ้นตามไปด้วย และ ตารางธาตุจะขยายเป็น 50 คอลัมน์ อย่างไรก็ตาม นักเคมีได้พัฒนารูปแบบที่กะทัดรัดมากขึ้นสำหรับโต๊ะกว้างเช่นนี้แล้ว 
ตารางธาตุที่สมบูรณ์ซึ่งมีแถวเต็มอาจปรากฏเป็นความฝันสุดท้ายของ Mendeleev และหากเป็นเช่นนั้น ก็จะไม่มีคุณลักษณะพิเศษของอัลเบิร์ต ไอน์สไตน์และของเขาอีกต่อไป ทฤษฎีพิเศษทฤษฎีสัมพัทธภาพ
เช่นเดียวกับในบ้านอื่นๆ มี "ทางเข้า" คือกลุ่ม ยิ่งไปกว่านั้น ในกลุ่ม องค์ประกอบต่างๆ จะตั้งอยู่ทางซ้ายและขวา ก่อตัวเป็นกลุ่มย่อย กลุ่มย่อยนั้นเรียกว่ากลุ่มหลักทั้งนี้ขึ้นอยู่กับด้านที่มีมากกว่า กลุ่มย่อยอื่น ๆ จะเป็นรองตามลำดับ ตารางยังมี "พื้น" หรือจุดด้วย นอกจากนี้ จุดอาจเป็นได้ทั้งขนาดใหญ่ (ประกอบด้วยสองแถว) และขนาดเล็ก (มีเพียงแถวเดียว)
เมื่อจำนวนองค์ประกอบเพิ่มขึ้น โปรตอนบวกในนิวเคลียสจะเพิ่มค่าบวก ค่าไฟฟ้า- ในเวลาเดียวกัน แรงดึงดูดของไฟฟ้าสถิตจะเพิ่มขึ้นเมื่ออิเล็กตรอนที่มีประจุลบ ดังนั้นพวกมันจึงเร่งความเร็วอย่างมากเมื่อเข้าใกล้แกนกลาง สิ่งนี้ทำให้อิเล็กตรอนในออร์บิทัลชั้นในที่มีลำดับสูงเข้าใกล้ความเร็วแสงอย่างรวดเร็ว เป็นผลให้มีการใช้ผลกระทบของสิ่งนี้มากขึ้น ตัวอย่างเช่น มวลของอิเล็กตรอนจะเพิ่มขึ้นเมื่อเวลาผ่านไป
สิ่งนี้จะทำให้วงโคจรสั้นลง โดยเฉพาะวงโคจรด้านใน แต่วงโคจรวงนอกจะเล็กลง และทำให้วงโคจรคงที่ในเวลาเดียวกัน ทั้งหมดนี้เรียกว่าผลสัมพัทธภาพโดยตรง อย่างไรก็ตาม ทฤษฎีสัมพัทธภาพยังก่อให้เกิดผลกระทบทางอ้อมที่ต่อต้านพวกมันด้วย เมื่ออิเล็กตรอนชั้นในเข้าใกล้นิวเคลียส พวกมันจะป้องกันประจุของพวกมันให้แข็งแกร่งยิ่งขึ้น ซึ่งจะช่วยลดแรงดึงดูดไฟฟ้าสถิตของอิเล็กตรอนชั้นนอก ส่งผลให้วงโคจรของเปลือกที่อยู่สูงกว่าขยายตัว
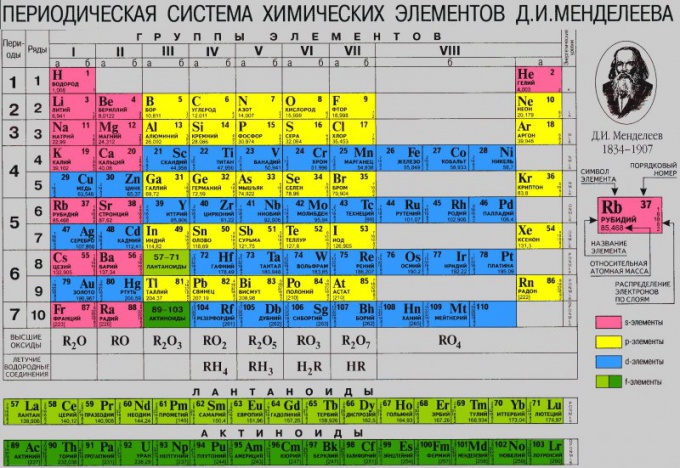
ตารางแสดงโครงสร้างของอะตอมของธาตุ ซึ่งแต่ละอะตอมมีนิวเคลียสที่มีประจุบวก ซึ่งประกอบด้วยโปรตอนและนิวตรอน เช่นเดียวกับอิเล็กตรอนที่มีประจุลบที่หมุนรอบอะตอม จำนวนโปรตอนและอิเล็กตรอนเป็นตัวเลขเท่ากันและถูกกำหนดในตารางตามหมายเลขซีเรียลขององค์ประกอบ ตัวอย่างเช่น ธาตุเคมีซัลเฟอร์คือ #16 ดังนั้นจะมีโปรตอน 16 ตัวและอิเล็กตรอน 16 ตัว
ทั้งหมดนี้สัมผัสได้เพียงบางส่วนในชีวิตประจำวัน ดังนั้น ผลกระทบเชิงสัมพัทธภาพทำให้ปรอทซึ่งเป็นโลหะชนิดเดียวกลายเป็นของเหลว พวกเขายังทำให้ทองคำมีสีเหลือง และเงินซึ่งอยู่เหนือตารางธาตุโดยตรงจะปรากฏเป็นสีฟ้าขาว หากโฟตอนที่มีความยาวคลื่นถูกต้องกระทบกับอะตอมของโลหะทรานซิชัน โฟตอนก็จะถูกดูดซับ ในกรณีของเงิน ช่องว่างพลังงานระหว่างออร์บิทัลทั้งสองนั้นมีมากพอที่จะทำให้การเปลี่ยนแปลงนี้ต้องใช้โฟตอนจากบริเวณอัลตราไวโอเลตของสเปกตรัม
ดังนั้นแสงที่มองเห็นได้แบบประหยัดพลังงานจึงเป็นเพียงการสะท้อน ดังนั้นโลหะจึงทำหน้าที่เป็นกระจกที่สมบูรณ์แบบสำหรับดวงตาของมนุษย์ ดังนั้นโฟตอนจากช่วงสเปกตรัมสีน้ำเงินจึงเพียงพอที่จะยกอิเล็กตรอนได้ ในทางกลับกัน แสงจากสีอื่นๆ ทั้งหมดก็ยังมีพลังไม่เพียงพอ มันยังคงสะท้อนอยู่ เราจึงเห็นแสงสีขาวลบด้วยแสงสีน้ำเงิน ซึ่งทำให้เกิดสีเหลืองทองที่มีลักษณะเฉพาะ ถึงหมายเลข 118 ทราบองค์ประกอบทั้งหมดแล้ว ดังนั้นตารางธาตุจึงสมบูรณ์ในรูปแบบปัจจุบัน
ในการหาจำนวนนิวตรอน (อนุภาคที่เป็นกลางยังอยู่ในนิวเคลียสด้วย) ให้ลบเลขอะตอมของมันออกจากมวลอะตอมสัมพัทธ์ของธาตุนั้น ตัวอย่างเช่น เหล็กมีมวลอะตอมสัมพัทธ์ 56 และเลขอะตอม 26 ดังนั้น 56 – 26 = 30 โปรตอนสำหรับเหล็ก
อิเล็กตรอนเปิดอยู่ ในระยะทางที่ต่างกันจากนิวเคลียสสร้างระดับอิเล็กทรอนิกส์ ในการกำหนดจำนวนระดับอิเล็กทรอนิกส์ (หรือพลังงาน) คุณต้องดูจำนวนช่วงเวลาที่องค์ประกอบนั้นอยู่ เช่นอลูมิเนียมอยู่ช่วงที่ 3 จึงจะมี 3 ระดับ
หากมีการเพิ่มองค์ประกอบเพิ่มเติม จะต้องสร้างซีรีส์ใหม่ให้พวกเขา Pekka Pykkö จากมหาวิทยาลัยเฮลซิงกิและคนอื่นๆ คาดการณ์ถึงผลกระทบเชิงสัมพัทธภาพเพิ่มเติมของทองคำ รวมถึงข้อเท็จจริงที่ว่ามันสามารถรวมตัวกับอะตอมอื่นๆ ในรูปแบบที่น่าประหลาดใจได้ สิ่งแปลกใหม่ไม่น้อยคือโมเลกุลทรงกลมซึ่งอะตอมของทังสเตนล้อมรอบด้วยอะตอมทองคำสิบสองอะตอม สารประกอบนี้มีโครงสร้างเดียวกับฟูลเลอรีนฟุตบอลที่มีชื่อเสียง ซึ่งประกอบด้วยอะตอมของคาร์บอน 60 อะตอม และเกิดขึ้นเองตามธรรมชาติโดยการระเหยของทังสเตนและทองคำในบรรยากาศของก๊าซป้องกันฮีเลียม
ด้วยหมายเลขกลุ่ม (แต่สำหรับกลุ่มย่อยหลักเท่านั้น) คุณสามารถกำหนดความจุสูงสุดได้ ตัวอย่างเช่น องค์ประกอบของกลุ่มแรกของกลุ่มย่อยหลัก (ลิเธียม โซเดียม โพแทสเซียม ฯลฯ) มีวาเลนซ์เป็น 1 ดังนั้น องค์ประกอบของกลุ่มที่สอง (เบริลเลียม แมกนีเซียม แคลเซียม ฯลฯ) จะมีวาเลนซ์เป็น 2.
คุณยังสามารถวิเคราะห์คุณสมบัติขององค์ประกอบโดยใช้ตารางได้ จากซ้ายไปขวา คุณสมบัติของโลหะจะลดลง และคุณสมบัติของอโลหะจะเพิ่มขึ้น สิ่งนี้เห็นได้ชัดเจนในตัวอย่างของช่วงที่ 2: เริ่มต้นด้วยโซเดียมของโลหะอัลคาไล จากนั้นจึงกลายเป็นแมกนีเซียมของโลหะอัลคาไลน์เอิร์ธ ตามด้วยอะลูมิเนียมที่เป็นส่วนประกอบของแอมโฟเทอริก จากนั้นจึงตามด้วยซิลิคอนที่ไม่ใช่โลหะ ฟอสฟอรัส ซัลเฟอร์ และช่วงที่สิ้นสุดด้วยสารที่เป็นก๊าซ - คลอรีนและอาร์กอน ในช่วงถัดไปจะสังเกตเห็นการพึ่งพาอาศัยกันที่คล้ายกัน
การคำนวณทางกลควอนตัมเชิงสัมพัทธภาพยังได้รับการพิสูจน์ว่ามีคุณค่าอย่างยิ่งในการตอบคำถามว่าอะตอมทองคำชิ้นเล็กๆ ทำหน้าที่เป็นตัวเร่งปฏิกิริยาได้อย่างไร เพื่อสลายสารพิษในไอเสียรถยนต์ แม้ว่าโดยทั่วไปแล้วโลหะมีค่าจะทำปฏิกิริยาได้ไม่ดีนักก็ตาม
แม้จะมีผลกระทบเชิงสัมพัทธภาพดังกล่าว แต่การเบี่ยงเบนไปจากลักษณะที่คาดหวังขององค์ประกอบนี้ยังคงมีจำกัด แม้แต่แอกติไนด์ซึ่งมีหมายเลขลำดับที่สูงกว่ามาก ก็มีคุณสมบัติที่สอดคล้องกับตำแหน่งในตารางธาตุ แย่จริงๆ แต่ก็น่าสนใจเช่นกัน - ความประหลาดใจเกิดขึ้นในองค์ประกอบหนักที่สร้างขึ้นเมื่อเร็ว ๆ นี้เท่านั้น เคมีของพวกมันเท่าที่เห็นได้จากการทดสอบครั้งก่อน บ่งชี้ถึงรอยแตกร้ายแรงในนิตยสาร
จากบนลงล่างจะสังเกตรูปแบบด้วย - คุณสมบัติของโลหะเพิ่มขึ้นและคุณสมบัติที่ไม่ใช่โลหะลดลง ตัวอย่างเช่น ซีเซียมมีฤทธิ์มากกว่าโซเดียมมาก
การค้นพบกฎธาตุและการสร้างระบบลำดับองค์ประกอบทางเคมี D.I. Mendeleev กลายเป็นผู้ยิ่งใหญ่แห่งการพัฒนาวิชาเคมีในศตวรรษที่ 19 นักวิทยาศาสตร์สรุปและจัดระบบความรู้ที่กว้างขวางเกี่ยวกับคุณสมบัติขององค์ประกอบ
นักฟิสิกส์สามารถยิงนิวเคลียสหนักในเครื่องเร่งอนุภาคเพื่อหลอมรวมเข้าด้วยกันและก่อตัวเป็นองค์ประกอบ "ซุปเปอร์เอเลเวอร์" ซึ่งเป็นหนึ่งในนั้นที่มีเลขลำดับ สองคนแรกคือรัทเทอร์ฟอร์เดียมและดับเนียม ในทำนองเดียวกัน ใน Dubnium จากกลุ่มย่อยที่ห้า มีหลักฐานว่า Dubnium มีพฤติกรรมเหมือน actinide protactinium ที่มีฤทธิ์มากกว่าเดิม
อย่างไรก็ตาม ตามกฎของช่วงเวลานั้น ทั้งสองควรมีคุณสมบัติทางเคมีคล้ายคลึงกันกับธาตุที่อยู่เหนือพวกมัน นั่นคือฮาฟเนียมและแทนทาลัม ภายใต้สภาวะเหล่านี้ เป็นไปไม่ได้ที่จะตรวจสอบคุณสมบัติทางเคมีโดยใช้เคมี "เปียก" แบบดั้งเดิม โดยนำพวกมันมารวมกันในรูปแบบที่ละลายกับคู่ปฏิกิริยาที่มีศักยภาพ และดูว่าเกิดอะไรขึ้น
คำแนะนำ
ในศตวรรษที่ 19 ไม่มีความคิดเกี่ยวกับโครงสร้างของอะตอม การค้นพบโดย D.I. Mendeleev เป็นเพียงคำอธิบายทั่วไปของข้อเท็จจริงเชิงทดลอง แต่ความหมายทางกายภาพของพวกมันยังไม่ชัดเจนมาเป็นเวลานาน เมื่อข้อมูลแรกปรากฏบนโครงสร้างของนิวเคลียสและการกระจายตัวของอิเล็กตรอนในอะตอม ทำให้สามารถพิจารณากฎธาตุและระบบองค์ประกอบในรูปแบบใหม่ได้ โต๊ะ ดี.ไอ. Mendeleev ทำให้สามารถติดตามช่วงเวลาของคุณสมบัติขององค์ประกอบที่พบในธรรมชาติได้ด้วยสายตา
อย่างไรก็ตาม นักวิจัยได้พัฒนาวิธีการที่ซับซ้อนเพื่อศึกษาเคมีขององค์ประกอบเหล่านี้ในแต่ละอะตอม ในการทดลองดังกล่าว Seaborgium และ Borium แสดงคุณสมบัติทางเคมีอีกครั้งซึ่งสอดคล้องกับตำแหน่งในตารางธาตุ เพื่อชี้แจงเรื่องนี้ ทีมวิจัยยังได้สังเคราะห์ไอโซโทปหนักที่ไม่เสถียรของธาตุทั้งสองชนิดที่เปรียบเทียบกัน เหตุผลก็คือสามารถผลิตและศึกษาได้ในลักษณะเดียวกับโคเปอร์นิเซียม ผลการทดลองจึงเหนือกว่าเมื่อเปรียบเทียบกับคุณสมบัติมหภาคของไอโซโทปธรรมชาติทั่วไป
แต่ละองค์ประกอบในตารางได้รับการกำหนดหมายเลขซีเรียลเฉพาะ (H - 1, Li - 2, Be - 3 เป็นต้น) จำนวนนี้สอดคล้องกับประจุนิวเคลียร์ (จำนวนโปรตอนในนิวเคลียส) และจำนวนอิเล็กตรอนที่โคจรรอบนิวเคลียส จำนวนโปรตอนจึงเท่ากับจำนวนอิเล็กตรอน ซึ่งหมายความว่าภายใต้สภาวะปกติ อะตอมจะมีความเป็นกลางทางไฟฟ้า
การแบ่งออกเป็นเจ็ดช่วงเกิดขึ้นตามจำนวนระดับพลังงานของอะตอม อะตอมของคาบแรกมีเปลือกอิเล็กตรอนระดับเดียว อะตอมที่สอง - สองระดับ ที่สาม - สามระดับ ฯลฯ เมื่อระดับพลังงานใหม่ถูกเติมเต็ม ช่วงเวลาใหม่จะเริ่มต้นขึ้น
ในการทดลอง อะตอมที่เพิ่งอบใหม่จะถูกสะสมบนพื้นผิวที่ถูกทำให้เย็นลงจนถึงอุณหภูมิที่ต่ำมาก และถูกปกคลุมไปด้วยทองคำบางส่วนและบางส่วนถูกปกคลุมด้วยน้ำแข็ง ถ้าโคเปอร์นิเซียมเป็นเหมือนปรอท ก็ควรเกิดเป็นอะมัลกัมกับทองคำ มีแนวโน้มว่ามันจะเป็นเรดอน แต่มันจะตกลงไปบนน้ำแข็งแทน แม้จะฟังดูง่ายเหมือนการทดลอง แต่ก็ไม่ได้ให้ผลลัพธ์ที่ชัดเจน: ห้องปฏิบัติการแต่ละแห่งได้รับผลลัพธ์ที่แตกต่างกัน ดังนั้นคำถามจึงยังคงเปิดอยู่
ยิ่งไปกว่านั้น จากการศึกษาเหล่านี้ พบว่าสารนี้มีความผันผวนมากกว่าปรอทและปรากฏเป็นก๊าซที่อุณหภูมิห้องด้วยซ้ำ หากตารางธาตุยังคงเพิ่มขึ้น การเพิ่มเติมใหม่ๆ มักจะให้ข้อมูลที่ถูกต้องมากขึ้นเกี่ยวกับความถูกต้องของตารางธาตุในกรณีขององค์ประกอบพิเศษ อย่างไรก็ตาม คำถามนี้ไม่มีความสำคัญในทางปฏิบัติในอนาคตอันใกล้นี้ หากอำนาจการทำนายหายไปพร้อมกับหมายเลขลำดับสูงสุด ประโยชน์ของตารางที่เหลือจะไม่ลดลง และนักเคมีทั่วไปไม่ควรจัดการกับธาตุที่มีน้ำหนักมากยิ่งยวด
องค์ประกอบแรกของช่วงเวลาใด ๆ มีลักษณะเป็นอะตอมที่มีอิเล็กตรอนหนึ่งตัวอยู่ที่ระดับด้านนอก - เหล่านี้คืออะตอมของโลหะอัลคาไล คาบจะลงท้ายด้วยอะตอมของก๊าซมีตระกูลซึ่งมีระดับพลังงานภายนอกที่เต็มไปด้วยอิเล็กตรอนโดยสมบูรณ์ ในช่วงแรกก๊าซมีตระกูลมีอิเล็กตรอน 2 ตัวในช่วงต่อๆ ไป - 8 เป็นเพราะโครงสร้างที่คล้ายกันของเปลือกอิเล็กตรอนที่ กลุ่มขององค์ประกอบมีคุณสมบัติทางเคมีกายภาพคล้ายคลึงกัน
เนื่องจากสารในปัจจุบันสามารถผลิตได้ในปริมาณเพียงเล็กน้อยเท่านั้นและมักจะสลายตัวภายในไม่กี่วินาที พวกมันจึงไม่สามารถทำอะไรกับพวกมันได้ อย่างไรก็ตาม จากแบบจำลองเปลือกของนิวเคลียสอะตอม องค์ประกอบที่มีจำนวนโปรตอนและนิวตรอน "มหัศจรรย์" ที่แน่นอน ซึ่งสอดคล้องกับเปลือกที่เต็มไป ควรจะมีเสถียรภาพเป็นพิเศษ ยาวผิดปกติอยู่ที่ 2.7 วินาที สิ่งนี้นำไปสู่คำถามทั่วไปว่าเมื่อใดรายการองค์ประกอบจะสิ้นสุดในที่สุด ตามความเห็นของผู้เชี่ยวชาญ ไม่มีนิวเคลียสของอะตอมเกิดขึ้นได้แม้เพียงชั่วครู่หากจำนวนโปรตอนสูงเกินไป
ในตาราง D.I. Mendeleev มีกลุ่มย่อยหลัก 8 กลุ่ม จำนวนนี้ถูกกำหนดโดยจำนวนอิเล็กตรอนสูงสุดที่เป็นไปได้ในระดับพลังงาน
ที่ด้านล่างของตารางธาตุ lanthanides และ actinides จะถูกแยกออกเป็นอนุกรมอิสระ
การใช้โต๊ะ D.I. Mendeleev เราสามารถสังเกตคาบของคุณสมบัติขององค์ประกอบต่อไปนี้: รัศมีอะตอม, ปริมาตรอะตอม; ศักยภาพไอออไนเซชัน แรงดึงดูดของอิเล็กตรอน อิเลคโตรเนกาติวีตี้ของอะตอม สถานะออกซิเดชัน; คุณสมบัติทางกายภาพของสารประกอบที่มีศักยภาพ
แต่เส้นขอบอยู่ที่ไหน มุมมองก็ต่างกัน ในการคำนวณแกนกลางแบบจุด ดูเหมือนว่าจะอยู่ในองค์ประกอบ 137 นักทฤษฎีอื่นๆ ประมาณการปริมาตรแกนกลางที่แท้จริงเป็น 172 หรือ 173 สำหรับองค์ประกอบที่ซับซ้อนที่สุด ทำให้มีพื้นที่เหลือเฟือสำหรับการค้นพบใหม่ๆ และนิวเคลียสที่ค่อนข้างเสถียรซึ่งสามารถสำรวจทางเคมีได้ นอกจากนี้ ตำแหน่งในตารางธาตุอาจไม่มีบทบาทใดๆ อีกต่อไป
ว่าด้วยประวัติความเป็นมาของระบบธาตุแบบคาบของศ. และโดยไม่มีการเตือนล่วงหน้า “ธาตุทอง” ยังหมายถึง “อะตอมของทองคำ” ที่ไม่สามารถมีจุดหลอมเหลวหรือกระแสตรงซึ่งไม่มีสีในแง่ที่เราเข้าใจสี แต่จะทำให้เกิดสีก็ต่อเมื่อมีอะตอมจำนวนมากเกิดขึ้นเท่านั้น ในอนุภาคของสารหรือส่วนของวัสดุ จากนั้นทองอาจเป็นสีแดง เขียว หรือเหลืองเมื่อมองในเวลากลางวัน การพิจารณาเรื่องธาตุถือเป็นเรื่องสำคัญที่สุดในศตวรรษนับตั้งแต่มีการพัฒนาตารางธาตุ
ตัวอย่างเช่น รัศมีของอะตอม เมื่อดูตามคาบหนึ่งจะลดลงจากซ้ายไปขวา เติบโตจากบนลงล่างเมื่อมองตามกลุ่ม
ระยะการจัดเรียงองค์ประกอบในตาราง D.I. Mendeleev ได้รับการอธิบายอย่างมีเหตุผลโดยธรรมชาติของการเติมระดับพลังงานด้วยอิเล็กตรอนตามลำดับ
แหล่งที่มา:
โดยหลักการแล้วสารพื้นฐานทุกชนิดนั้นอย่างน้อยก็ประกอบด้วยอะตอมที่เหมือนกัน ดังนั้นอะตอมของบิลเลียดทุกอะตอมจึงเป็นอะตอมแปลกปลอม ชาวอังกฤษ Robert Boyle ถือได้ว่าเป็นผู้ก่อตั้งเคมีสมัยใหม่: เขาเป็นคนแรกที่จำแนกกรดเป็นสารที่เปลี่ยนสีย้อมพืชสีน้ำเงินให้เป็นสีแดงและละลายหินอ่อน เหตุผลอาจทำให้กระบวนการนี้ย้อนกลับได้ นอกจากนี้เขายังโต้แย้งอย่างน่าเชื่อว่าไม่มีธาตุสี่ชนิด ได้แก่ น้ำ ดิน ไฟ ลม แต่มีองค์ประกอบอื่นๆ อีกมากที่อธิบายความหลากหลายของสสาร และต้องตั้งชื่อสสารที่รวมกันเป็นหนึ่งเดียวกัน ซึ่งไม่ว่าในกรณีใดก็ตาม จะไม่สามารถถ่ายโอนไปยังอีกสององค์ประกอบที่แตกต่างกันได้ สาร
- ตารางธาตุ
กฎหมายเป็นระยะซึ่งเป็นพื้นฐานของเคมีสมัยใหม่และอธิบายรูปแบบของการเปลี่ยนแปลงคุณสมบัติขององค์ประกอบทางเคมีถูกค้นพบโดย D.I. เมนเดเลเยฟในปี พ.ศ. 2412 ความหมายทางกายภาพของกฎข้อนี้เปิดเผยโดยการศึกษาโครงสร้างที่ซับซ้อนของอะตอม

เป็นที่ทราบกันว่าน้ำผลิตไฮโดรเจนบวกออกซิเจนจากเถ้ามะนาวบวกคาร์บอนไดออกไซด์ แต่กำมะถันจะยังคงเป็นเพียงกำมะถันเสมอ ตราบใดที่มันร้อนขึ้นหรือไหลออกไป พวกมันก็พยายามทำให้อิเล็กโทรไลต์ด้วย หัวข้อของการประชุมครั้งนี้คือการตั้งชื่อสารประกอบเคมีและการเป็นตัวแทนอย่างเป็นทางการ ตลอดจนคำถามเกี่ยวกับน้ำหนักอะตอมและโมเลกุลของสารประกอบเคมี ทั้ง Mendeleev และ Meyer พัฒนาระบบของพวกเขาจากแรงจูงใจในการสอน: เพื่อให้ภาพรวมของความอุดมสมบูรณ์ของสารทั้งหมดที่ได้รับการระบุแล้วและที่ยังคงถูกระบุ
ในศตวรรษที่ 19 เชื่อกันว่ามวลอะตอมเป็นคุณลักษณะหลักของธาตุ จึงถูกนำมาใช้ในการจำแนกประเภทสาร ในปัจจุบัน อะตอมถูกกำหนดและระบุด้วยปริมาณประจุบนนิวเคลียส (จำนวนโปรตอนและเลขอะตอมในตารางธาตุ) อย่างไรก็ตาม มวลอะตอมของธาตุ (เช่น มวลอะตอมของโพแทสเซียมน้อยกว่ามวลอะตอมของอาร์กอน) จะเพิ่มขึ้นตามสัดส่วนของประจุนิวเคลียร์ โดยมีข้อยกเว้นบางประการ (เช่น มวลอะตอมของโพแทสเซียมน้อยกว่ามวลอะตอมของอาร์กอน)
สำหรับคำถามที่ลึกซึ้งยิ่งกว่านั้นว่าสารพื้นฐานไม่สามารถสืบย้อนไปถึงสสารปฐมภูมิเพียงสารเดียวได้หรือไม่ “โปรโตไฮล์” เมนเดเลเยฟและเมเยอร์แตกต่างกัน เมเยอร์ ซึ่งเป็นสมมติฐานที่พัฒนาโดยชาวอังกฤษ วิลเลียม พราวธ์ ขึ้นอยู่กับสสารทั้งหมดในท้ายที่สุดที่ประกอบด้วยไฮโดรเจนที่มีการควบแน่นสูง ในขณะที่เมนเดเลเยฟขัดแย้งกับความไม่สอดคล้องกันของมวลโมลาร์ของสสารอะตอม ในเวลานั้น ทั้งเมนเดเลเยฟและเมเยอร์ไม่อาจทราบได้ว่าในช่วงไมโครของโปรตอน นิวตรอน และอิเล็กตรอน กฎการอนุรักษ์มวลไม่สามารถนำมาใช้ได้อีกต่อไป เนื่องจากน้ำหนักที่เท่ากันของมวลและพลังงาน
เมื่อมวลอะตอมเพิ่มขึ้นจะมีการเปลี่ยนแปลงคุณสมบัติขององค์ประกอบและสารประกอบเป็นระยะ สิ่งเหล่านี้คือความเป็นโลหะและความเป็นโลหะของอะตอม รัศมีและปริมาตรของอะตอม ศักยภาพไอออไนเซชัน สัมพรรคภาพอิเล็กตรอน อิเล็กโตรเนกาติวีตี้ สถานะออกซิเดชัน คุณสมบัติทางกายภาพของสารประกอบ (จุดเดือด จุดหลอมเหลว ความหนาแน่น) ความเป็นพื้นฐาน แอมโฟเทอริซิตี หรือความเป็นกรด
ตารางธาตุสมัยใหม่มีองค์ประกอบกี่องค์ประกอบ
ตารางธาตุแสดงกฎธาตุที่เขาค้นพบเป็นภาพกราฟิก ตารางธาตุสมัยใหม่ประกอบด้วยองค์ประกอบทางเคมี 112 ชนิด (ธาตุสุดท้าย ได้แก่ ไมต์เนเรียม ดาร์มสตัดเทียม เรินต์เกเนียม และโคเปอร์นิเซียม) จากข้อมูลล่าสุด พบว่ามีการค้นพบองค์ประกอบ 8 รายการต่อไปนี้ (รวมมากถึง 120 รายการ) แต่ไม่ใช่ทั้งหมดที่ได้รับชื่อ และองค์ประกอบเหล่านี้ยังมีน้อยในสิ่งพิมพ์ใดๆ
แต่ละองค์ประกอบครอบครองเซลล์เฉพาะในตารางธาตุและมีหมายเลขซีเรียลของตัวเองซึ่งสอดคล้องกับประจุของนิวเคลียสของอะตอม
ตารางธาตุถูกสร้างขึ้นมาอย่างไร?
โครงสร้างของตารางธาตุประกอบด้วยคาบ 7 คาบ 10 แถว และ 8 กลุ่ม แต่ละช่วงเริ่มต้นด้วยโลหะอัลคาไลและสิ้นสุดด้วยก๊าซมีตระกูล ข้อยกเว้นคือช่วงแรกซึ่งเริ่มต้นด้วยไฮโดรเจน และช่วงที่เจ็ดที่ไม่สมบูรณ์
ช่วงเวลาแบ่งเป็นช่วงเล็กและช่วงใหญ่ ช่วงเล็ก (ครั้งแรก ที่สอง สาม) ประกอบด้วยแถวแนวนอนหนึ่งแถว ช่วงขนาดใหญ่ (สี่ ห้า หก) - ของสองแถวแนวนอน แถวบนในช่วงกว้างเรียกว่าคู่ แถวล่างเรียกว่าคี่
ในช่วงที่หกของตารางหลังแลนทานัม (หมายเลขซีเรียล 57) มี 14 องค์ประกอบที่มีคุณสมบัติคล้ายกับแลนทานัม - แลนทาไนด์ โดยจะแสดงรายการไว้ที่ด้านล่างของตารางเป็นบรรทัดแยกกัน เช่นเดียวกับแอกติไนด์ซึ่งอยู่หลังแอกทิเนียม (หมายเลข 89) และส่วนใหญ่จะทำซ้ำคุณสมบัติของมัน
แถวคู่ของช่วงเวลาขนาดใหญ่ (4, 6, 8, 10) จะเต็มไปด้วยโลหะเท่านั้น
องค์ประกอบในกลุ่มแสดงความจุสูงสุดของออกไซด์และสารประกอบอื่นๆ ที่เท่ากัน และความจุนี้สอดคล้องกับหมายเลขกลุ่ม กลุ่มย่อยหลักประกอบด้วยองค์ประกอบของช่วงเวลาเล็กและใหญ่ ส่วนกลุ่มย่อย - เฉพาะกลุ่มใหญ่เท่านั้น จากบนลงล่างคุณสมบัติของโลหะจะเพิ่มขึ้นคุณสมบัติที่ไม่ใช่โลหะจะลดลง อะตอมของกลุ่มย่อยด้านข้างทั้งหมดเป็นโลหะ
เมื่อการดัดแปลงองค์ประกอบทางเคมีนี้ได้รับความร้อนสูงกว่า 220°C และต่อมาถูกทำให้เย็นลง จะเกิดเป็นซีลีเนียมคล้ายแก้ว ซึ่งจะเปราะบางและมีความแวววาวคล้ายแก้ว
ความเสถียรทางความร้อนมากที่สุดคือซีลีเนียมสีเทาหกเหลี่ยมซึ่งมีโครงตาข่ายซึ่งสร้างจากโซ่เกลียวของอะตอมที่ขนานกัน ผลิตโดยการให้ความร้อนกับซีลีเนียมรูปแบบอื่นจนละลายและค่อยๆ เย็นลงจนถึงอุณหภูมิ 180-210°C ภายในสายโซ่ซีลีเนียมหกเหลี่ยม อะตอมจะถูกพันธะโควาเลนต์
ซีลีเนียมมีความเสถียรในอากาศ ไม่ได้รับผลกระทบจากออกซิเจน น้ำ กรดซัลฟิวริกเจือจางและกรดไฮโดรคลอริก แต่จะละลายได้ดีในกรดไนตริก เมื่อทำปฏิกิริยากับโลหะ ซีลีเนียมจะเกิดเป็นซีลีไนด์ มีสารประกอบเชิงซ้อนของซีลีเนียมที่ทราบกันดีอยู่หลายชนิด ซึ่งทั้งหมดเป็นพิษ
ซีลีเนียมได้มาจากของเสียจากการผลิตกระดาษหรือกรดซัลฟิวริกโดยการกลั่นทองแดงด้วยไฟฟ้า องค์ประกอบนี้มีอยู่ในตะกอนพร้อมกับโลหะหนักและโลหะมีตระกูล ซัลเฟอร์ และเทลลูเรียม ในการสกัด ตะกอนจะถูกกรอง จากนั้นให้ความร้อนด้วยกรดซัลฟิวริกเข้มข้น หรือนำไปย่างแบบออกซิเดชันที่อุณหภูมิ 700°C

คำแนะนำ
จากภาษาละติน "แคลเซียม" แปลว่า "มะนาว" หรือ "หินอ่อน" และเป็นหนี้การค้นพบของชาวอังกฤษ Humphry Davy ซึ่งในปี 1808 สามารถแยกแคลเซียมได้โดยวิธีอิเล็กโทรไลต์ จากนั้น นักวิทยาศาสตร์ได้นำส่วนผสมของปูนขาวเปียก "ปรุงรส" กับเมอร์คิวริกออกไซด์ แล้วนำไปผ่านกระบวนการอิเล็กโทรลิซิสบนแผ่นแพลตตินัม ซึ่งปรากฏในการทดลองเป็นขั้วบวก แคโทดเป็นลวดที่นักเคมีจุ่มลงในปรอทเหลว สิ่งที่น่าสนใจอีกอย่างคือสารประกอบแคลเซียม เช่น หินปูน หินอ่อน ยิปซั่ม รวมถึงปูนขาว เป็นที่รู้จักของมนุษยชาติมาหลายศตวรรษก่อนการทดลองของเดวี ซึ่งในระหว่างนั้นนักวิทยาศาสตร์เชื่อว่าสารประกอบบางส่วนเป็นวัตถุที่เรียบง่ายและเป็นอิสระ จนกระทั่งปี ค.ศ. 1789 ชาวฝรั่งเศส Lavoisier ได้ตีพิมพ์ผลงานที่เขาเสนอว่ามะนาว ซิลิกา แบไรท์ และอลูมินาเป็นสารที่ซับซ้อน
แคลเซียมมีฤทธิ์ทางเคมีในระดับสูงด้วยเหตุนี้เอง รูปแบบบริสุทธิ์แทบไม่เคยพบเห็นในธรรมชาติเลย แต่นักวิทยาศาสตร์ประเมินว่าธาตุนี้มีสัดส่วนประมาณ 3.38% ของมวลรวมของเปลือกโลก ทำให้แคลเซียมมีมากเป็นอันดับที่ 5 รองจากออกซิเจน ซิลิคอน อลูมิเนียม และเหล็ก องค์ประกอบนี้พบได้ในน้ำทะเล - ประมาณ 400 มก. ต่อลิตร แคลเซียมยังรวมอยู่ในองค์ประกอบของซิลิเกตของหินต่าง ๆ (เช่นหินแกรนิตและ gneisses) มีจำนวนมากในเฟลด์สปาร์ ชอล์ก และหินปูน ซึ่งประกอบด้วยแร่แคลไซต์ที่มีสูตร CaCO3 แคลเซียมในรูปแบบผลึกคือหินอ่อน โดยรวมแล้วจากการอพยพของธาตุนี้ในเปลือกโลกทำให้เกิดแร่ธาตุ 385 ชนิด
คุณสมบัติทางกายภาพของแคลเซียมรวมถึงความสามารถในการแสดงความสามารถด้านเซมิคอนดักเตอร์ที่มีคุณค่า แม้ว่าจะไม่กลายเป็นเซมิคอนดักเตอร์และโลหะตามความหมายดั้งเดิมก็ตาม การเปลี่ยนแปลง สถานการณ์นี้โดยมีความดันเพิ่มขึ้นทีละน้อย เมื่อแคลเซียมได้รับสถานะเป็นโลหะและความสามารถในการแสดงคุณสมบัติของตัวนำยิ่งยวด แคลเซียมทำปฏิกิริยากับออกซิเจน ความชื้นในอากาศ และคาร์บอนไดออกไซด์ได้ง่าย ซึ่งเป็นเหตุผลว่าทำไมในห้องปฏิบัติการ องค์ประกอบทางเคมีนี้จึงถูกเก็บไว้ในขวดที่ปิดสนิทเพื่อใช้ในการทำงาน
ประวัติความเป็นมาของตารางธาตุ
ในช่วงกลางศตวรรษที่ 19 นักวิทยาศาสตร์สามารถค้นพบองค์ประกอบทางเคมีได้หกสิบสามองค์ประกอบ แต่พวกเขาไม่สามารถสร้างห่วงโซ่ตรรกะที่สอดคล้องกันจากองค์ประกอบเหล่านั้นได้ มีการวางแผนที่จะวางธาตุต่าง ๆ เพื่อเพิ่มมวลอะตอมและแบ่งออกเป็นกลุ่มตามคุณสมบัติทางเคมีที่คล้ายคลึงกัน
เป็นครั้งแรกที่นักดนตรีและนักเคมี John Alexander Newland เสนอทฤษฎีของเขาซึ่งคล้ายกับทฤษฎีในอนาคตของ Mendeleev แต่ชุมชนวิทยาศาสตร์เพิกเฉยต่อความสำเร็จของเขา ข้อเสนอของนิวแลนด์ไม่ได้ถูกนำมาพิจารณาอย่างจริงจัง เพราะเขาค้นหาความสามัคคีและความเชื่อมโยงระหว่างดนตรีและเคมี
ดมิตรี เมนเดเลเยฟ ตีพิมพ์ตารางธาตุของเขาเป็นครั้งแรกในปี พ.ศ. 2412 ในหน้าวารสารสมาคมเคมีแห่งรัสเซีย นักวิทยาศาสตร์ยังได้ส่งประกาศการค้นพบของเขาไปยังนักเคมีชั้นนำของโลกทุกคน หลังจากนั้นเขาก็ปรับปรุงและปรับปรุงตารางซ้ำแล้วซ้ำเล่าจนกระทั่งกลายเป็นที่รู้จักในปัจจุบัน สาระสำคัญของการค้นพบของ Dmitry Mendeleev คือการเปลี่ยนแปลงเป็นระยะ ๆ แทนที่จะเป็นการเปลี่ยนแปลงคุณสมบัติทางเคมีขององค์ประกอบที่น่าเบื่อหน่ายเมื่อมวลอะตอมเพิ่มขึ้น การรวมทฤษฎีครั้งสุดท้ายเข้ากับกฎเป็นระยะเกิดขึ้นในปี พ.ศ. 2414
ตำนานเกี่ยวกับ Mendeleev
ตำนานที่พบบ่อยที่สุดคือการค้นพบตารางธาตุในความฝัน นักวิทยาศาสตร์เองก็เยาะเย้ยตำนานนี้ซ้ำแล้วซ้ำเล่าโดยอ้างว่าเขาคิดโต๊ะนี้มาหลายปีแล้ว ตามตำนานอีกเรื่องหนึ่ง Dmitry Mendeleev คิดค้นวอดก้า - ปรากฏหลังจากที่นักวิทยาศาสตร์ปกป้องวิทยานิพนธ์ของเขาเรื่อง "วาทกรรมเกี่ยวกับการผสมผสานแอลกอฮอล์กับน้ำ"
Mendeleev ยังถือว่าหลายคนเป็นผู้ค้นพบวอดก้าซึ่งตัวเขาเองชอบที่จะสร้างขึ้นภายใต้สารละลายแอลกอฮอล์น้ำ ผู้ร่วมสมัยของนักวิทยาศาสตร์มักจะหัวเราะเยาะห้องทดลองของ Mendeleev ซึ่งเขาสร้างขึ้นในโพรงของต้นโอ๊กขนาดยักษ์
เหตุผลอีกประการหนึ่งของเรื่องตลกตามข่าวลือคือความหลงใหลในการทอกระเป๋าเดินทางของ Dmitry Mendeleev ซึ่งนักวิทยาศาสตร์มีส่วนร่วมขณะอาศัยอยู่ใน Simferopol ต่อมาเขาทำภาชนะกระดาษแข็งด้วยมือของเขาเองตามความต้องการของห้องปฏิบัติการ ซึ่งเขาถูกเรียกว่าเป็นผู้เชี่ยวชาญด้านการทำกระเป๋าเดินทางอย่างประชดประชัน
ตารางธาตุนอกเหนือจากการเรียงลำดับธาตุเคมีแล้ว ระบบแบบครบวงจรทำให้สามารถทำนายการค้นพบองค์ประกอบใหม่มากมาย อย่างไรก็ตาม ในเวลาเดียวกัน นักวิทยาศาสตร์ยอมรับว่าบางส่วนไม่มีอยู่จริง เนื่องจากไม่สอดคล้องกับแนวคิดเรื่องกฎเป็นระยะ ที่สุด ประวัติศาสตร์ที่รู้จักในเวลานั้นมีการค้นพบธาตุใหม่เช่นโคโรเนียมและเนบิวเลียม
เพื่อความสะดวกควรใช้ตารางเวอร์ชันสีจะดีกว่า
ระบบธาตุเป็นชุดลำดับขององค์ประกอบทางเคมี การจำแนกตามธรรมชาติ ซึ่งเป็นการแสดงออกแบบกราฟิก (ตาราง) ของกฎธาตุขององค์ประกอบทางเคมี โครงสร้างของมันในหลาย ๆ ด้านคล้ายกับสมัยใหม่ได้รับการพัฒนาโดย D. I. Mendeleev บนพื้นฐานของกฎหมายเป็นระยะในปี พ.ศ. 2412-2414
ต้นแบบของระบบธาตุคือ "ประสบการณ์ของระบบธาตุตามน้ำหนักอะตอมและความคล้ายคลึงกันทางเคมี" รวบรวมโดย D. I. Mendeleev เมื่อวันที่ 1 มีนาคม พ.ศ. 2412 ตลอดระยะเวลาสองปีครึ่ง นักวิทยาศาสตร์ได้ปรับปรุงอย่างต่อเนื่อง “ประสบการณ์ของระบบ” แนะนำแนวคิดเกี่ยวกับกลุ่ม อนุกรม และช่วงเวลาขององค์ประกอบ เป็นผลให้โครงสร้างของตารางธาตุได้รับโครงร่างที่ทันสมัยเป็นส่วนใหญ่
แนวคิดเกี่ยวกับตำแหน่งขององค์ประกอบในระบบซึ่งกำหนดโดยจำนวนของกลุ่มและช่วงเวลา มีความสำคัญต่อวิวัฒนาการของมัน จากแนวคิดนี้ Mendeleev ได้ข้อสรุปว่าจำเป็นต้องเปลี่ยนมวลอะตอมขององค์ประกอบบางอย่าง ได้แก่ ยูเรเนียม อินเดียม ซีเรียม และดาวเทียม นี่เป็นครั้งแรก การประยุกต์ใช้จริงระบบเป็นระยะ เมนเดเลเยฟยังทำนายเป็นครั้งแรกถึงการดำรงอยู่และคุณสมบัติขององค์ประกอบที่ไม่รู้จักหลายอย่าง นักวิทยาศาสตร์ได้อธิบายรายละเอียดคุณสมบัติที่สำคัญที่สุดของเอคา-อะลูมิเนียม (อนาคตของแกลเลียม), เอคา-โบรอน (สแกนเดียม) และเอคา-ซิลิคอน (เจอร์เมเนียม) นอกจากนี้เขายังทำนายการมีอยู่ของแมงกานีสที่คล้ายคลึงกัน (เทคนีเชียมและรีเนียมในอนาคต), เทลลูเรียม (โพโลเนียม), ไอโอดีน (แอสทาทีน), ซีเซียม (ฝรั่งเศส), แบเรียม (เรเดียม), แทนทาลัม (โปรแทกติเนียม) การคาดการณ์ของนักวิทยาศาสตร์เกี่ยวกับองค์ประกอบเหล่านี้มีลักษณะทั่วไป เนื่องจากองค์ประกอบเหล่านี้อยู่ในพื้นที่ที่มีการศึกษาน้อยในตารางธาตุ
ระบบคาบเวอร์ชันแรกแสดงเพียงลักษณะทั่วไปเชิงประจักษ์เท่านั้น ท้ายที่สุดแล้ว ความหมายทางกายภาพของกฎธาตุยังไม่ชัดเจน ไม่มีคำอธิบายถึงสาเหตุของการเปลี่ยนแปลงคุณสมบัติขององค์ประกอบเป็นระยะ ขึ้นอยู่กับการเพิ่มขึ้นของมวลอะตอม ในเรื่องนี้ปัญหาหลายประการยังไม่ได้รับการแก้ไข ตารางธาตุมีขอบเขตหรือไม่? เป็นไปได้หรือไม่ที่จะระบุจำนวนองค์ประกอบที่มีอยู่ที่แน่นอน? โครงสร้างของยุคที่ 6 ยังไม่ชัดเจน - ธาตุหายากมีปริมาณเท่าใดกันแน่? ไม่มีใครรู้ว่าธาตุระหว่างไฮโดรเจนและลิเธียมยังคงมีอยู่หรือไม่ โครงสร้างของยุคแรกเป็นอย่างไร ดังนั้นจนถึงการพิสูจน์ทางกายภาพของกฎเป็นระยะและการพัฒนาทฤษฎีของระบบธาตุ ความยากลำบากร้ายแรงจึงเกิดขึ้นมากกว่าหนึ่งครั้ง การค้นพบในปี พ.ศ. 2437-2441 เป็นเรื่องที่ไม่คาดคิด ก๊าซเฉื่อย 5 ชนิดที่ดูเหมือนจะไม่มีอยู่ในตารางธาตุ ความยากลำบากนี้ถูกขจัดออกไปด้วยแนวคิดที่จะรวมกลุ่มศูนย์อิสระไว้ในโครงสร้างของตารางธาตุ การค้นพบธาตุรังสีจำนวนมากในช่วงเปลี่ยนศตวรรษที่ 19 และ 20 (ภายในปี 1910 มีจำนวนประมาณ 40 ตัว) ทำให้เกิดความขัดแย้งอย่างมากระหว่างความจำเป็นในการใส่ไว้ในตารางธาตุกับโครงสร้างที่มีอยู่ มีตำแหน่งงานว่างเพียง 7 ตำแหน่งสำหรับพวกเขาในช่วงที่หกและเจ็ด ปัญหานี้แก้ไขได้ด้วยการสร้างกฎการเปลี่ยนแปลงและการค้นพบไอโซโทป
สาเหตุหลักประการหนึ่งที่ทำให้ไม่สามารถอธิบายความหมายทางกายภาพของกฎธาตุและโครงสร้างของระบบธาตุไม่ได้ก็คือ ไม่ทราบว่าอะตอมมีโครงสร้างอย่างไร (ดูอะตอม) เหตุการณ์สำคัญที่สุดในการพัฒนาตารางธาตุคือการสร้างแบบจำลองอะตอมโดย E. Rutherford (1911) โดยพื้นฐานแล้ว นักวิทยาศาสตร์ชาวดัตช์ A. Van den Broek (1913) แนะนำว่าเลขลำดับของธาตุในตารางธาตุเป็นตัวเลขเท่ากับประจุของนิวเคลียสของอะตอม (Z) สิ่งนี้ได้รับการยืนยันจากการทดลองโดยนักวิทยาศาสตร์ชาวอังกฤษ G. Moseley (1913) กฎธาตุได้รับเหตุผลทางกายภาพ: การพิจารณาระยะของการเปลี่ยนแปลงคุณสมบัติขององค์ประกอบเริ่มได้รับการพิจารณาโดยขึ้นอยู่กับประจุ Z ของนิวเคลียสของอะตอมขององค์ประกอบ และไม่ขึ้นอยู่กับมวลอะตอม (ดูกฎธาตุขององค์ประกอบเคมี)
เป็นผลให้โครงสร้างของตารางธาตุมีความเข้มแข็งมากขึ้นอย่างมีนัยสำคัญ กำหนดขีดจำกัดล่างของระบบแล้ว นี่คือไฮโดรเจน - องค์ประกอบที่มีค่า Z = 1 ขั้นต่ำ สามารถประมาณจำนวนองค์ประกอบระหว่างไฮโดรเจนและยูเรเนียมได้อย่างแม่นยำ “ช่องว่าง” ในตารางธาตุถูกระบุ ซึ่งสอดคล้องกับองค์ประกอบที่ไม่รู้จักซึ่งมี Z = 43, 61, 72, 75, 85, 87 อย่างไรก็ตาม คำถามเกี่ยวกับจำนวนที่แน่นอนของธาตุหายากยังคงไม่ชัดเจน และที่สำคัญที่สุดคือ เหตุผลของ ช่วงเวลาของการเปลี่ยนแปลงคุณสมบัติขององค์ประกอบยังไม่ชัดเจนขึ้นอยู่กับ Z
จากโครงสร้างที่กำหนดขึ้นของระบบธาตุและผลการศึกษาสเปกตรัมอะตอม นักวิทยาศาสตร์ชาวเดนมาร์ก เอ็น. บอร์ในปี พ.ศ. 2461-2464 พัฒนาแนวคิดเกี่ยวกับลำดับการสร้างเปลือกอิเล็กทรอนิกส์และเปลือกย่อยในอะตอม นักวิทยาศาสตร์ได้ข้อสรุปว่าการกำหนดค่าทางอิเล็กทรอนิกส์ประเภทเดียวกันของเปลือกนอกของอะตอมนั้นถูกทำซ้ำเป็นระยะ ดังนั้นจึงแสดงให้เห็นว่าการเปลี่ยนแปลงคุณสมบัติขององค์ประกอบทางเคมีนั้นอธิบายได้โดยการมีอยู่ของช่วงเวลาในการสร้างเปลือกอิเล็กทรอนิกส์และเปลือกย่อยของอะตอม
ตารางธาตุครอบคลุมมากกว่า 100 ธาตุ ในจำนวนนี้องค์ประกอบ transuranic ทั้งหมด (Z = 93–110) รวมถึงองค์ประกอบที่มี Z = 43 (เทคนีเซียม), 61 (โพรมีเทียม), 85 (แอสทาทีน), 87 (แฟรนเซียม) ได้รับมาแบบเทียม ตลอดประวัติศาสตร์ของการดำรงอยู่ของตารางธาตุ มีการเสนอตัวแปรจำนวนมาก (>500) ภาพกราฟิกส่วนใหญ่อยู่ในรูปแบบของตารางตลอดจนในรูปแบบของรูปทรงเรขาคณิตต่างๆ (เชิงพื้นที่และระนาบ) เส้นโค้งการวิเคราะห์ (เกลียว ฯลฯ ) ฯลฯ ที่แพร่หลายมากที่สุดคือรูปแบบสั้น, กึ่งยาว, ยาวและแบบขั้นบันได ตาราง ปัจจุบันนิยมใช้แบบสั้น
หลักการพื้นฐานของการสร้างตารางธาตุคือการแบ่งออกเป็นกลุ่มและคาบ แนวคิดเรื่องอนุกรมองค์ประกอบต่างๆ ของเมนเดเลเยฟไม่ได้ใช้ในปัจจุบัน เนื่องจากไม่มีความหมายทางกายภาพ ในทางกลับกัน กลุ่มจะถูกแบ่งออกเป็นกลุ่มย่อยหลัก (a) และรอง (b) แต่ละกลุ่มย่อยประกอบด้วยองค์ประกอบ - อะนาล็อกทางเคมี องค์ประกอบของกลุ่มย่อย a- และ b ในกลุ่มส่วนใหญ่ก็แสดงความคล้ายคลึงกันบางประการเช่นกัน โดยส่วนใหญ่อยู่ในสถานะออกซิเดชันที่สูงกว่า ซึ่งตามกฎแล้วจะเท่ากับหมายเลขกลุ่ม คาบคือกลุ่มของธาตุที่ขึ้นต้นด้วยโลหะอัลคาไลและสิ้นสุดด้วยก๊าซเฉื่อย (กรณีพิเศษคือคาบแรก) แต่ละช่วงเวลามีจำนวนองค์ประกอบที่กำหนดไว้อย่างเคร่งครัด ตารางธาตุประกอบด้วยแปดหมู่และเจ็ดคาบ โดยคาบที่เจ็ดยังสร้างไม่เสร็จ
ลักษณะเฉพาะ อันดับแรกคาบคือประกอบด้วยธาตุก๊าซในรูปอิสระเพียง 2 ธาตุ คือ ไฮโดรเจนและฮีเลียม ตำแหน่งไฮโดรเจนในระบบมีความคลุมเครือ เนื่องจากมันแสดงคุณสมบัติทั่วไปของโลหะอัลคาไลและฮาโลเจน จึงถูกวางไว้ในกลุ่ม 1a- หรือในกลุ่มย่อย Vlla หรือทั้งสองอย่างพร้อมกัน โดยใส่สัญลักษณ์ไว้ในวงเล็บในกลุ่มย่อยกลุ่มใดกลุ่มหนึ่ง ฮีเลียมเป็นตัวแทนกลุ่มแรกของกลุ่มย่อย VIIIa เป็นเวลานานที่ฮีเลียมและก๊าซเฉื่อยทั้งหมดถูกแยกออกเป็นกลุ่มศูนย์อิสระ ตำแหน่งนี้จำเป็นต้องมีการแก้ไขหลังจากการสังเคราะห์สารประกอบทางเคมีคริปตอน ซีนอน และเรดอน เป็นผลให้ก๊าซมีตระกูลและองค์ประกอบของกลุ่ม VIII เดิม (เหล็ก โคบอลต์ นิกเกิล และโลหะแพลตตินัม) ถูกรวมเข้าด้วยกันภายในกลุ่มเดียว
ที่สองคาบมี 8 ธาตุ เริ่มต้นด้วยลิเธียมโลหะอัลคาไลซึ่งมีสถานะออกซิเดชันเพียง +1 ถัดมาคือเบริลเลียม (โลหะ สถานะออกซิเดชัน +2) โบรอนแสดงลักษณะโลหะได้น้อยอยู่แล้วและไม่ใช่โลหะ (สถานะออกซิเดชัน +3) ถัดจากโบรอน คาร์บอนเป็นอโลหะทั่วไปที่มีสถานะออกซิเดชัน +4 และ −4 ไนโตรเจน ออกซิเจน ฟลูออรีน และนีออนล้วนไม่ใช่โลหะ โดยไนโตรเจนมีสถานะออกซิเดชันสูงสุดที่ +5 ซึ่งสอดคล้องกับหมายเลขหมู่ ออกซิเจนและฟลูออรีนเป็นหนึ่งในอโลหะที่มีฤทธิ์มากที่สุด นีออนก๊าซเฉื่อยจะสิ้นสุดคาบ
ที่สามคาบ (โซเดียม-อาร์กอน) ก็ประกอบด้วยธาตุ 8 ธาตุเช่นกัน ธรรมชาติของการเปลี่ยนแปลงคุณสมบัติส่วนใหญ่คล้ายกับที่สังเกตได้จากองค์ประกอบของช่วงที่สอง แต่ยังมีความเฉพาะเจาะจงบางอย่างที่นี่ ดังนั้นแมกนีเซียมซึ่งแตกต่างจากเบริลเลียมจึงมีโลหะมากกว่าเช่นเดียวกับอลูมิเนียมเมื่อเทียบกับโบรอน ซิลิคอน ฟอสฟอรัส ซัลเฟอร์ คลอรีน อาร์กอน ล้วนแต่ไม่ใช่โลหะทั่วไป และทั้งหมด ยกเว้นอาร์กอน มีสถานะออกซิเดชันที่สูงกว่าซึ่งเท่ากับหมายเลขหมู่
ดังที่เราเห็นในทั้งสองช่วง เมื่อค่า Z เพิ่มขึ้น ก็จะมีการอ่อนตัวลงของโลหะอย่างเห็นได้ชัด และคุณสมบัติที่ไม่ใช่โลหะของธาตุก็จะเพิ่มขึ้นอย่างเห็นได้ชัด D.I. Mendeleev เรียกองค์ประกอบของช่วงที่สองและสาม (ในคำพูดของเขาเล็ก) โดยทั่วไป องค์ประกอบของช่วงเวลาเล็กๆ ถือเป็นองค์ประกอบที่พบบ่อยที่สุดในธรรมชาติ คาร์บอน ไนโตรเจน และออกซิเจน (รวมถึงไฮโดรเจน) เป็นออร์กาโนเจน ซึ่งเป็นองค์ประกอบหลักของอินทรียวัตถุ
องค์ประกอบทั้งหมดของคาบแรก-สามจะถูกจัดอยู่ในกลุ่มย่อย
ที่สี่คาบ (โพแทสเซียม-คริปทอน) มี 18 ธาตุ ตามความเห็นของ Mendeleev นี่เป็นช่วงเวลาสำคัญครั้งแรก หลังจากที่โพแทสเซียมของโลหะอัลคาไลและแคลเซียมของโลหะอัลคาไลน์เอิร์ทจะมีองค์ประกอบหลายอย่างที่ประกอบด้วยโลหะทรานซิชัน 10 ชนิด (สแกนเดียม - สังกะสี) ทั้งหมดรวมอยู่ในกลุ่มย่อย b โลหะทรานซิชันส่วนใหญ่มีสถานะออกซิเดชันที่สูงกว่าซึ่งเท่ากับเลขหมู่ ยกเว้นเหล็ก โคบอลต์ และนิกเกิล ธาตุตั้งแต่แกลเลียมไปจนถึงคริปทอน อยู่ในกลุ่มย่อย a สารประกอบทางเคมีหลายชนิดเป็นที่รู้จักสำหรับคริปทอน
ประการที่ห้าคาบ (รูบิเดียม - ซีนอน) มีโครงสร้างคล้ายกับคาบที่สี่ นอกจากนี้ยังมีโลหะทรานซิชัน 10 ชนิด (อิตเทรียม - แคดเมียม) องค์ประกอบของยุคนี้มีลักษณะเป็นของตัวเอง ในรูทีเนียมสาม - โรเดียม - แพลเลเดียม สารประกอบเป็นที่รู้จักสำหรับรูทีเนียมซึ่งมีสถานะออกซิเดชันที่ +8 องค์ประกอบทั้งหมดของกลุ่มย่อย a แสดงสถานะออกซิเดชันที่สูงกว่าเท่ากับหมายเลขกลุ่ม คุณลักษณะของการเปลี่ยนแปลงคุณสมบัติขององค์ประกอบของช่วงเวลาที่สี่และห้าเมื่อ Z เพิ่มขึ้นนั้นซับซ้อนกว่าเมื่อเปรียบเทียบกับช่วงเวลาที่สองและสาม
ที่หกคาบ (ซีเซียม - เรดอน) ประกอบด้วยธาตุ 32 ธาตุ ช่วงนี้นอกเหนือจากโลหะทรานซิชัน 10 ชนิด (แลนทานัม แฮฟเนียม - ปรอท) ยังมีชุดแลนทาไนด์ 14 ชนิดตั้งแต่ซีเรียมไปจนถึงลูทีเซียม ธาตุตั้งแต่ซีเรียมไปจนถึงลูทีเซียมมีความคล้ายคลึงกันทางเคมีมาก และด้วยเหตุนี้ธาตุเหล่านี้จึงถูกรวมอยู่ในตระกูลธาตุหายากมานานแล้ว ในรูปแบบย่อของตารางธาตุ ชุดของแลนทาไนด์จะรวมอยู่ในเซลล์แลนทานัม และการถอดรหัสของอนุกรมนี้จะระบุไว้ที่ด้านล่างของตาราง (ดูแลนทาไนด์)
ธาตุยุคที่ 6 มีความเฉพาะเจาะจงอย่างไร? ในออสเมียมสาม - อิริเดียม - แพลตตินัม สถานะออกซิเดชันของ +8 เป็นที่รู้จักสำหรับออสเมียม แอสทาทีนมีลักษณะเป็นโลหะค่อนข้างเด่นชัด เรดอนมีปฏิกิริยามากที่สุดในบรรดาก๊าซมีตระกูลทั้งหมด น่าเสียดาย เนื่องจากมีกัมมันตภาพรังสีสูง จึงมีการศึกษาทางเคมีเพียงเล็กน้อย (ดูองค์ประกอบกัมมันตภาพรังสี)
ที่เจ็ดระยะเวลาเริ่มต้นจากประเทศฝรั่งเศส เช่นเดียวกับองค์ประกอบที่หก ควรมีองค์ประกอบ 32 รายการ แต่ 24 องค์ประกอบยังคงเป็นที่รู้จัก แฟรนเซียมและเรเดียมเป็นองค์ประกอบของกลุ่มย่อย Ia และ IIa ตามลำดับ แอกทิเนียมอยู่ในกลุ่มย่อย IIIb ถัดมาคือตระกูลแอกติไนด์ ซึ่งประกอบด้วยธาตุตั้งแต่ทอเรียมไปจนถึงลอเรนเซียม และจัดวางในลักษณะเดียวกับแลนทาไนด์ การถอดรหัสองค์ประกอบชุดนี้มีให้ที่ด้านล่างของตารางด้วย
ทีนี้เรามาดูกันว่าคุณสมบัติขององค์ประกอบทางเคมีเปลี่ยนแปลงไปอย่างไร กลุ่มย่อยระบบเป็นระยะ รูปแบบหลักของการเปลี่ยนแปลงนี้คือการเสริมความแข็งแกร่งของลักษณะโลหะขององค์ประกอบเมื่อ Z เพิ่มขึ้น รูปแบบนี้ปรากฏชัดเจนเป็นพิเศษในกลุ่มย่อย IIIa–VIIa สำหรับโลหะของกลุ่มย่อย Ia–IIIa จะพบว่ามีฤทธิ์ทางเคมีเพิ่มขึ้น สำหรับองค์ประกอบของกลุ่มย่อย IVa–VIIa เมื่อ Z เพิ่มขึ้น กิจกรรมทางเคมีขององค์ประกอบจะลดลง สำหรับองค์ประกอบกลุ่มย่อย b ลักษณะของการเปลี่ยนแปลงในกิจกรรมทางเคมีนั้นซับซ้อนกว่า
ทฤษฎีระบบคาบได้รับการพัฒนาโดยเอ็น. บอร์และนักวิทยาศาสตร์คนอื่นๆ ในช่วงทศวรรษที่ 20 ศตวรรษที่ XX และขึ้นอยู่กับ โครงการที่แท้จริงการก่อตัวของการกำหนดค่าทางอิเล็กทรอนิกส์ของอะตอม (ดูอะตอม) ตามทฤษฎีนี้ เมื่อ Z เพิ่มขึ้น การเติมเปลือกอิเล็กตรอนและเปลือกย่อยในอะตอมของธาตุที่รวมอยู่ในคาบของตารางธาตุจะเกิดขึ้นในลำดับต่อไปนี้:
| หมายเลขงวด | ||||||
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 1 วินาที | 2s2p | 3s3p | 4s3d4p | 5s4d5p | 6s4f5d6p | 7s5f6d7p |
ตามทฤษฎีของระบบคาบ เราสามารถให้คำจำกัดความของคาบได้ดังต่อไปนี้ คาบคือชุดขององค์ประกอบที่เริ่มต้นด้วยองค์ประกอบที่มีค่า n เท่ากับจำนวนคาบ และ l = 0 (องค์ประกอบ s) และสิ้นสุด ด้วยองค์ประกอบที่มีค่าเท่ากัน n และ l = 1 (องค์ประกอบ p) (ดู Atom) ข้อยกเว้นคือช่วงแรกซึ่งมีองค์ประกอบเพียง 1 วินาที จากทฤษฎีระบบคาบ จำนวนองค์ประกอบในช่วงเวลามีดังนี้ 2, 8, 8, 18, 18, 32...
ในตารางสัญลักษณ์ขององค์ประกอบแต่ละประเภท (องค์ประกอบ s-, p-, d- และ f) จะแสดงบนพื้นหลังสีเฉพาะ: องค์ประกอบ s - บนสีแดง, องค์ประกอบ p - บนสีส้ม, องค์ประกอบ d - บนสีน้ำเงิน องค์ประกอบ f - บนสีเขียว แต่ละเซลล์จะแสดงเลขอะตอมและมวลอะตอมของธาตุต่างๆ ตลอดจนการกำหนดค่าทางอิเล็กทรอนิกส์ของเปลือกอิเล็กตรอนชั้นนอก
จากทฤษฎีของระบบคาบ เป็นไปตามที่กลุ่มย่อย a รวมองค์ประกอบที่มี n เท่ากับจำนวนงวด และ l = 0 และ 1 กลุ่มย่อย b รวมองค์ประกอบเหล่านั้นในอะตอมที่ความสมบูรณ์ของเปลือกที่เหลืออยู่ก่อนหน้านี้ ไม่สมบูรณ์เกิดขึ้น นั่นคือสาเหตุที่คาบที่ 1, 2 และ 3 ไม่มีองค์ประกอบของกลุ่มย่อย b
โครงสร้างของตารางธาตุมีความสัมพันธ์อย่างใกล้ชิดกับโครงสร้างของอะตอมขององค์ประกอบทางเคมี เมื่อ Z เพิ่มขึ้น โครงสร้างประเภทเดียวกันของเปลือกอิเล็กตรอนด้านนอกจะเกิดซ้ำเป็นระยะๆ กล่าวคือกำหนดคุณสมบัติหลักของพฤติกรรมทางเคมีขององค์ประกอบ คุณลักษณะเหล่านี้แสดงออกมาแตกต่างกันสำหรับองค์ประกอบของกลุ่มย่อย a (องค์ประกอบ s- และ p) สำหรับองค์ประกอบของกลุ่มย่อย b (องค์ประกอบการเปลี่ยนแปลง d) และองค์ประกอบของตระกูล f - แลนทาไนด์และแอกติไนด์ กรณีพิเศษแสดงโดยองค์ประกอบของคาบแรก - ไฮโดรเจนและฮีเลียม ไฮโดรเจนมีลักษณะพิเศษคือมีฤทธิ์ทางเคมีสูง เนื่องจากมีอิเล็กตรอนเพียง 1 วินาทีเท่านั้นที่ถูกกำจัดออกได้ง่าย ในเวลาเดียวกันการกำหนดค่าของฮีเลียม (1 วินาที 2) มีความเสถียรมากซึ่งเป็นตัวกำหนดว่าไม่มีการใช้งานทางเคมี
สำหรับองค์ประกอบของกลุ่มย่อย a เปลือกอิเล็กตรอนด้านนอกของอะตอมจะถูกเติมเต็ม (โดยที่ n เท่ากับจำนวนคาบ) ดังนั้นคุณสมบัติขององค์ประกอบเหล่านี้จะเปลี่ยนไปอย่างเห็นได้ชัดเมื่อ Z เพิ่มขึ้น ดังนั้นในช่วงที่สอง ลิเธียม (การกำหนดค่า 2 วินาที ) เป็นโลหะแอคทีฟที่สูญเสียเวเลนซ์อิเล็กตรอนเพียงตัวเดียวได้อย่างง่ายดาย เบริลเลียม (2s 2) ก็เป็นโลหะเช่นกัน แต่มีปฏิกิริยาน้อยกว่าเนื่องจากอิเล็กตรอนชั้นนอกของมันจับกับนิวเคลียสแน่นกว่า นอกจากนี้ โบรอน (2s 2 p) มีลักษณะเป็นโลหะที่แสดงออกมาเล็กน้อย และองค์ประกอบที่ตามมาทั้งหมดของคาบที่สองซึ่งมีการสร้างเปลือกย่อย 2p นั้นเป็นอโลหะอยู่แล้ว โครงสร้างอิเล็กตรอน 8 ตัวของเปลือกอิเล็กตรอนด้านนอกของนีออน (2s 2 p 6) ซึ่งเป็นก๊าซเฉื่อย มีความแข็งแรงมาก
คุณสมบัติทางเคมีขององค์ประกอบของคาบที่สองอธิบายได้ด้วยความปรารถนาของอะตอมที่ต้องการการกำหนดค่าทางอิเล็กทรอนิกส์ของก๊าซเฉื่อยที่ใกล้ที่สุด (การกำหนดค่าฮีเลียมสำหรับองค์ประกอบจากลิเธียมเป็นคาร์บอน หรือการกำหนดค่านีออนสำหรับองค์ประกอบจากคาร์บอนเป็นฟลูออรีน) ด้วยเหตุนี้ ออกซิเจนจึงไม่สามารถแสดงสถานะออกซิเดชันที่สูงกว่าเท่ากับหมายเลขกลุ่มได้ กล่าวคือ ง่ายกว่าที่จะให้ออกซิเจนได้รับการกำหนดค่านีออนโดยการรับอิเล็กตรอนเพิ่มเติม ลักษณะการเปลี่ยนแปลงคุณสมบัติแบบเดียวกันนั้นปรากฏในองค์ประกอบของคาบที่สามและในองค์ประกอบ s และ p ของคาบต่อมาทั้งหมด ในเวลาเดียวกัน ความแรงของพันธะระหว่างอิเล็กตรอนชั้นนอกและนิวเคลียสในกลุ่ม a-subgroups เมื่อ Z เพิ่มขึ้นนั้นอ่อนลงจะแสดงในคุณสมบัติขององค์ประกอบที่เกี่ยวข้อง ดังนั้น สำหรับองค์ประกอบ S จะมีฤทธิ์ทางเคมีเพิ่มขึ้นอย่างเห็นได้ชัดเมื่อ Z เพิ่มขึ้น และสำหรับองค์ประกอบ p จะมีคุณสมบัติเป็นโลหะเพิ่มขึ้น
ในอะตอมขององค์ประกอบ d การเปลี่ยนแปลง เปลือกที่ไม่สมบูรณ์ก่อนหน้านี้จะสมบูรณ์ด้วยค่าของเลขควอนตัมหลัก n ซึ่งน้อยกว่าเลขคาบหนึ่งค่า ด้วยข้อยกเว้นบางประการ โครงร่างของเปลือกอิเล็กตรอนชั้นนอกของอะตอมขององค์ประกอบทรานซิชันคือ ns 2 ดังนั้น องค์ประกอบ d ทั้งหมดจึงเป็นโลหะ และนั่นคือเหตุผลว่าทำไมการเปลี่ยนแปลงคุณสมบัติขององค์ประกอบ d เมื่อ Z เพิ่มขึ้นจึงไม่คมชัดเท่ากับการเปลี่ยนแปลงที่สังเกตได้จากองค์ประกอบ s และ p ในสถานะออกซิเดชันที่สูงกว่า องค์ประกอบ d จะแสดงความคล้ายคลึงกับองค์ประกอบ p ของกลุ่มที่สอดคล้องกันในตารางธาตุ
ลักษณะเฉพาะของคุณสมบัติขององค์ประกอบของ triads (กลุ่มย่อย VIIIb) ได้รับการอธิบายโดยข้อเท็จจริงที่ว่า b-subshells ใกล้จะเสร็จสมบูรณ์แล้ว นี่คือเหตุผลว่าทำไมเหล็ก โคบอลต์ นิกเกิล และโลหะแพลตตินัม ตามกฎแล้ว จึงไม่มีแนวโน้มว่าจะผลิตสารประกอบในสถานะออกซิเดชันที่สูงกว่า ข้อยกเว้นเพียงอย่างเดียวคือรูทีเนียมและออสเมียม ซึ่งให้ออกไซด์ RuO 4 และ OsO 4 สำหรับองค์ประกอบของกลุ่มย่อย Ib และ IIb นั้น d-subshell นั้นสมบูรณ์แล้ว ดังนั้นจึงแสดงสถานะออกซิเดชันเท่ากับหมายเลขกลุ่ม
ในอะตอมของแลนทาไนด์และแอกติไนด์ (ทั้งหมดเป็นโลหะ) เปลือกอิเล็กตรอนที่ไม่สมบูรณ์ก่อนหน้านี้จะเสร็จสมบูรณ์โดยค่าของเลขควอนตัมหลัก n จะน้อยกว่าเลขคาบ 2 หน่วย ในอะตอมขององค์ประกอบเหล่านี้ โครงร่างของเปลือกอิเล็กตรอนด้านนอก (ns 2) ยังคงไม่เปลี่ยนแปลง และเปลือก N ด้านนอกตัวที่สามเต็มไปด้วยอิเล็กตรอน 4f นี่คือสาเหตุที่แลนทาไนด์มีความคล้ายคลึงกันมาก
สำหรับแอกติไนด์ สถานการณ์มีความซับซ้อนมากขึ้น ในอะตอมของธาตุที่มี Z = 90–95 อิเล็กตรอน 6d และ 5f สามารถมีส่วนร่วมในปฏิกิริยาทางเคมีได้ ดังนั้นแอกติไนด์จึงมีสถานะออกซิเดชันอีกมากมาย ตัวอย่างเช่น สำหรับเนปทูเนียม พลูโทเนียม และอะเมริเซียม สารประกอบเป็นที่ทราบกันดีว่าองค์ประกอบเหล่านี้ปรากฏในสถานะเฮปตะวาเลนต์ สำหรับองค์ประกอบเท่านั้น เริ่มต้นด้วยคูเรียม (Z = 96) สถานะไตรวาเลนต์จะเสถียร แต่ก็มีลักษณะเฉพาะของตัวเองเช่นกัน ดังนั้นคุณสมบัติของแอกติไนด์จึงแตกต่างอย่างมากจากคุณสมบัติของแลนทาไนด์ และทั้งสองตระกูลจึงไม่สามารถถือว่าคล้ายกันได้
ตระกูลแอกติไนด์ลงท้ายด้วยธาตุที่มี Z = 103 (ลอว์เรนเซียม) การประเมินคุณสมบัติทางเคมีของเคอร์ชาโตเวียม (Z = 104) และนิลสบอเรียม (Z = 105) แสดงให้เห็นว่าองค์ประกอบเหล่านี้ควรมีความคล้ายคลึงกับแฮฟเนียมและแทนทาลัมตามลำดับ ดังนั้นนักวิทยาศาสตร์เชื่อว่าหลังจากตระกูลแอกติไนด์ในอะตอม การเติมเปลือกย่อย 6d อย่างเป็นระบบก็เริ่มขึ้น ลักษณะทางเคมีขององค์ประกอบที่มี Z = 106–110 ยังไม่ได้รับการประเมินจากการทดลอง
ไม่ทราบจำนวนองค์ประกอบสุดท้ายที่ครอบคลุมในตารางธาตุ ปัญหาเกี่ยวกับขีดจำกัดบนอาจเป็นปริศนาหลักของตารางธาตุ ธาตุที่หนักที่สุดที่ถูกค้นพบในธรรมชาติคือ พลูโตเนียม (Z = 94) ถึงขีดจำกัดของปฏิกิริยานิวเคลียร์ฟิวชันเทียมแล้ว - องค์ประกอบที่มีเลขอะตอม 110 ยังคงอยู่ คำถามเปิด: เป็นไปได้ไหมที่จะได้องค์ประกอบที่มีซีเรียลนัมเบอร์ขนาดใหญ่ อันไหน และจำนวนเท่าไหร่? ยังไม่สามารถตอบได้อย่างแน่ชัด
ด้วยความช่วยเหลือของการคำนวณที่ซับซ้อนดำเนินการทางอิเล็กทรอนิกส์ คอมพิวเตอร์นักวิทยาศาสตร์พยายามกำหนดโครงสร้างของอะตอมและประเมินคุณสมบัติที่สำคัญที่สุดของ "องค์ประกอบพิเศษ" ลงไปจนถึงเลขลำดับขนาดใหญ่ (Z = 172 และแม้แต่ Z = 184) ผลลัพธ์ที่ได้ค่อนข้างคาดไม่ถึง ตัวอย่างเช่น ในอะตอมขององค์ประกอบที่มี Z = 121 คาดว่าจะมีอิเล็กตรอน 8p ปรากฏขึ้น นี่เป็นหลังจากการก่อตัวของชั้นย่อย 8s เสร็จสิ้นในอะตอมที่มี Z = 119 และ 120 แต่การปรากฏตัวของ p-อิเล็กตรอนหลัง s-อิเล็กตรอนจะสังเกตได้เฉพาะในอะตอมขององค์ประกอบของคาบที่สองและสามเท่านั้น การคำนวณยังแสดงให้เห็นว่าในองค์ประกอบของคาบที่แปดสมมุติ การเติมเปลือกอิเล็กตรอนและเปลือกย่อยของอะตอมเกิดขึ้นในลำดับที่ซับซ้อนและไม่เหมือนใคร ดังนั้นการประเมินคุณสมบัติขององค์ประกอบที่เกี่ยวข้องจึงเป็นปัญหาที่ยากมาก ดูเหมือนว่าช่วงที่แปดควรมี 50 องค์ประกอบ (Z = 119–168) แต่จากการคำนวณควรสิ้นสุดที่องค์ประกอบด้วย Z = 164 เช่น 4 หมายเลขซีเรียลก่อนหน้านี้ และช่วงที่เก้าที่ "แปลกใหม่" ปรากฎว่าควรประกอบด้วย 8 องค์ประกอบ นี่คือรายการ "อิเล็กทรอนิกส์" ของเขา: 9s 2 8p 4 9p 2 กล่าวอีกนัยหนึ่ง มันจะมีเพียง 8 องค์ประกอบ เช่นช่วงที่สองและสาม
เป็นการยากที่จะบอกว่าการคำนวณโดยใช้คอมพิวเตอร์จะเป็นจริงเพียงใด อย่างไรก็ตาม หากได้รับการยืนยัน ก็จำเป็นต้องพิจารณารูปแบบที่เป็นพื้นฐานของตารางธาตุและโครงสร้างของธาตุอีกครั้งอย่างจริงจัง
ตารางธาตุมีบทบาทอย่างมากต่อการพัฒนาวิทยาศาสตร์ธรรมชาติในสาขาต่างๆ เธอปรากฏตัวขึ้น ความสำเร็จที่สำคัญที่สุดการสอนอะตอม-โมเลกุลมีส่วนทำให้เกิดแนวคิดสมัยใหม่เรื่อง "องค์ประกอบทางเคมี" และการชี้แจงแนวคิดเกี่ยวกับสารและสารประกอบเชิงเดี่ยว
ความสม่ำเสมอที่เปิดเผยโดยระบบคาบมีผลกระทบอย่างมีนัยสำคัญต่อการพัฒนาทฤษฎีโครงสร้างอะตอม การค้นพบไอโซโทป และการเกิดขึ้นของแนวคิดเกี่ยวกับคาบของนิวเคลียร์ ระบบคาบมีความเกี่ยวข้องกับการกำหนดทางวิทยาศาสตร์อย่างเคร่งครัดของปัญหาการพยากรณ์ในวิชาเคมี สิ่งนี้แสดงให้เห็นในการทำนายการดำรงอยู่และคุณสมบัติขององค์ประกอบที่ไม่รู้จักและคุณสมบัติใหม่ของพฤติกรรมทางเคมีขององค์ประกอบที่ค้นพบแล้ว ปัจจุบันตารางธาตุเป็นรากฐานของเคมีซึ่งส่วนใหญ่เป็นอนินทรีย์ซึ่งช่วยแก้ปัญหาการสังเคราะห์สารเคมีของสารที่มีคุณสมบัติที่กำหนดไว้ล่วงหน้าได้อย่างมีนัยสำคัญการพัฒนาสารใหม่ วัสดุเซมิคอนดักเตอร์การเลือกตัวเร่งปฏิกิริยาเฉพาะสำหรับกระบวนการทางเคมีต่างๆ เป็นต้น และสุดท้าย ระบบคาบเป็นรากฐานของการสอนวิชาเคมี
