Tableau périodique Tableau périodique. Halogènes et gaz rares.
Instruction
Le système périodique est une "maison" à plusieurs étages dans laquelle se trouvent un grand nombre d'appartements. Chaque "locataire" ou élément chimique vit dans son propre appartement sous un certain nombre, qui est permanent. En outre, l'élément a un «nom de famille» ou un nom, tel que l'oxygène, le bore ou l'azote. En plus de ces données, chaque «appartement» ou cellule contient des informations telles que la masse atomique relative, qui peuvent avoir des valeurs exactes ou arrondies.
Effets dérangeants de la relativité
Si d’autres éléments étaient synthétisés, ils figureraient dans la nouvelle série du système. Neuf, ils offrent un espace pour deux électrons supplémentaires, comme auparavant, de sorte que la période entière sera prolongée en conséquence et que le système périodique s'étendra à 50 colonnes; Cependant, les chimistes ont déjà développé des vues plus compactes pour une table aussi large. 
Un système périodique complet, dont les séries sont complètement remplies, peut apparaître comme la réalisation ultime du rêve de Mendeleïev. Et s'il en était ainsi, Albert Einstein et sa théorie spéciale de la relativité ne présenteraient aucune particularité.
Comme dans toute maison, il y a des «entrées», à savoir des groupes. De plus, les groupes d'éléments sont situés à gauche et à droite, formant des sous-groupes. Selon le côté où ils sont plus grands, ce sous-groupe est appelé le principal. L'autre sous-groupe, respectivement, sera accessoire. Il y a aussi dans le tableau des "étages" ou des périodes. De plus, les périodes peuvent être à la fois grandes (deux rangées) et petites (une seule rangée).
Lorsque le nombre d'éléments augmente, un proton positif dans le noyau augmente sa charge électrique positive. En même temps, son attraction électrostatique se développe sur des électrons chargés négativement. Par conséquent, ils sont grandement accélérés lorsqu'ils approchent du noyau. Cela conduit au fait que les électrons des orbitales internes aux ordres élevés s'approchent si rapidement de la vitesse de la lumière. En conséquence, les effets de ceci sont de plus en plus appliqués. Par exemple, la masse des électrons augmente alors que le temps est étiré.
Cela réduit l’orbite, en particulier l’interne, mais dans une moindre mesure l’extérieure, et la stabilise en même temps. Tout cela s'appelle un effet relativiste direct. Cependant, la relativité produit également des effets indirects qui les neutralisent. Lorsque les électrons internes s'approchent du noyau, ils protègent plus fortement leur charge. Cela réduit l'attraction électrostatique des électrons externes, ce qui entraîne l'expansion des orbitales des couches supérieures.
Le tableau peut montrer la structure d'un atome d'un élément, chacun d'eux ayant un noyau chargé positivement constitué de protons et de neutrons, ainsi que des électrons chargés négativement tournant autour de lui. Le nombre de protons et d'électrons coïncide numériquement et est déterminé dans le tableau par le nombre ordinal de l'élément. Par exemple, l'élément chimique soufre a le numéro 16, il aura donc 16 protons et 16 électrons.
Tout cela se ressent même en partie dans la vie quotidienne. Ainsi, les effets relativistes font que le mercure est le seul métal liquide. Ils donnent également à l’or sa couleur jaunâtre et l’argent, situé directement au-dessus de lui dans le système périodique, a une apparence bleu-blanc. Si un photon de longueur d'onde correcte tombe sur un atome de métal de transition, il est absorbé. Dans le cas de l'argent, le fossé énergétique entre les deux orbitales est suffisamment important pour que cette transition nécessite un photon de la région ultraviolette du spectre.
Par conséquent, la lumière visible économe en énergie est simplement réfléchie, le métal agit donc comme un miroir idéal pour l'œil humain. Par conséquent, les photons de la gamme spectrale bleue suffisent pour lever un électron. Par contre, la lumière de toutes les autres couleurs n’est pas encore suffisamment énergique. Donc, il rebondit toujours, nous voyons donc une lumière blanche moins bleue, qui donne une couleur jaune or caractéristique. Jusqu'au numéro 118, tous les éléments sont maintenant connus. Ainsi, le système périodique est complet dans sa forme actuelle.
Pour déterminer le nombre de neutrons (particules neutres, également situées dans le noyau), soustrayez son numéro de série de la masse atomique relative de l'élément. Par exemple, le fer a une masse atomique relative de 56 et le numéro atomique 26. Par conséquent, 56 - 26 = 30 protons pour le fer.
Les électrons sont à différentes distances du noyau, formant des niveaux électroniques. Pour déterminer le nombre de niveaux électroniques (ou énergétiques), vous devez examiner le numéro de la période dans laquelle l'élément est situé. Par exemple, l’aluminium est en 3ème période, il aura donc 3 niveaux.
Si des éléments supplémentaires étaient ajoutés, il était nécessaire de créer une nouvelle série pour eux. Pekka Pikkö de l'Université d'Helsinki et d'autres ont prédit d'autres effets relativistes sur l'or, y compris le fait qu'il pourrait se combiner à d'autres atomes de manière étonnante. Non moins exotique est une molécule sphérique dans laquelle l'atome de tungstène est entouré de douze atomes d'or. Ce composé a la même structure que le célèbre fullerène de football, composé de 60 atomes de carbone, et se forme spontanément lors de l'évaporation du tungstène et de l'or dans une atmosphère de gaz protecteur à l'hélium.
Par numéro de groupe (mais uniquement pour le sous-groupe principal), on peut déterminer la valence la plus élevée. Par exemple, les éléments du premier groupe du sous-groupe principal (lithium, sodium, potassium, etc.) ont la valence 1. Par conséquent, les éléments du deuxième groupe (béryllium, magnésium, calcium, etc.) auront une valence égale à 2.
Également sur la table, vous pouvez analyser les propriétés des éléments. De gauche à droite, les propriétés métalliques s'affaiblissent et les propriétés non métalliques augmentent. Ceci est clairement visible dans l'exemple de la période 2: le sodium commence par les métaux alcalins, puis les métaux alcalino-terreux de magnésium, l'aluminium après l'élément amphotère, puis le silicium, les non-métaux, le phosphore, le soufre et se termine par des substances gazeuses - chlore et argon. Dans la période suivante, une dépendance similaire est observée.
Les calculs quantiques relativistes de la mécanique quantique se sont également révélés irremplaçables pour répondre à la question de savoir comment de minuscules atomes d'atomes d'or agissent en tant que catalyseurs, de sorte qu'ils décomposent les substances toxiques contenues dans les gaz d'échappement des voitures, bien que le métal précieux ne réagisse généralement pas très bien.
Malgré ces effets relativistes, les écarts par rapport à la nature attendue de cet élément sont encore limités. Même les actinides avec leurs nombres ordinaux beaucoup plus élevés ont en commun des propriétés correspondant à leur position dans le système périodique. Vraiment dommage, mais aussi intéressant, des surprises ne se sont révélées que dans les éléments lourds nouvellement créés. D'après les tests précédents, leur composition chimique indique de graves fissures dans le chargeur.
Un motif est également observé de haut en bas: les propriétés métalliques sont améliorées et les non métalliques sont affaiblies. C'est-à-dire que, par exemple, le césium est beaucoup plus actif que le sodium.
La découverte du droit périodique et la création d'un système ordonné d'éléments chimiques D.I. Mendeleev est devenu l'apogée du développement de la chimie au XIXe siècle. Les scientifiques ont été compilés et ont systématisé un important matériel de connaissances sur les propriétés des éléments.
Les physiciens peuvent extraire des noyaux lourds dans des accélérateurs de particules afin de les fusionner et de former les éléments d'un «super-ascenseur» - l'un d'eux avec des nombres ordinaux. Les deux premiers étaient Ruterford et Dubnium. De même, chez Dubnia du cinquième sous-groupe, il est prouvé qu'il se comporte comme un actinoïde protactinium encore plus actif.
Cependant, selon la loi de l'époque, leurs propriétés chimiques devaient être similaires à celles des éléments immédiatement supérieurs, à savoir le hafnium et le tantale. Dans ces conditions, il est impossible d'étudier leurs propriétés chimiques à l'aide de la chimie traditionnelle «humide» - recueillez-les sous forme dissoute avec des partenaires de réaction potentiels et voyez ce qui se passe.
Instruction
Au XIXème siècle, la structure de l'atome n'était pas connue. Découverte D.I. Mendeleev n'était qu'une généralisation des faits expérimentaux, mais leur signification physique est restée obscure pendant longtemps. Lorsque les premières données sur la structure du noyau et sur la distribution des électrons dans les atomes sont apparues, cela a permis d’examiner sous un nouveau jour la loi périodique et le système d’éléments. Tableau D.I. Mendeleev permet de tracer visuellement la périodicité des propriétés des éléments présents dans la nature.
Cependant, les chercheurs ont développé des méthodes complexes pour étudier la chimie de ces éléments sur des atomes individuels. Seaborgium et Borium ont à nouveau montré des propriétés chimiques correspondant à leur position dans le système périodique. Pour clarifier cela, les équipes de recherche ont également synthétisé des isotopes lourds instables des deux éléments comparatifs. La raison en était qu'ils pouvaient être produits et étudiés de la même manière que Copernicium. En conséquence, les résultats des expériences étaient meilleurs que les propriétés macroscopiques d’isotopes naturels plus fréquents.
Un numéro de séquence spécifique est attribué à chaque élément du tableau (H-1, Li-2, Be-3, etc.). Ce nombre correspond à la charge du noyau (le nombre de protons dans le noyau) et au nombre d'électrons en rotation autour du noyau. Le nombre de protons est donc égal au nombre d'électrons, ce qui suggère que l'atome est électriquement neutre dans des conditions normales.
La division en sept périodes se produit en fonction du nombre de niveaux d'énergie atomique. Les atomes de la première période ont une couche d'électrons à un seul niveau, le second - un à deux niveaux, le troisième - un à trois niveaux, etc. Lorsque vous remplissez un nouveau niveau d'énergie, une nouvelle période commence.
Lors d'expériences, des atomes fraîchement cuits se sont déposés à la surface, qui a été refroidie à très basse température et partiellement recouverte d'or, en partie de glace. Si le copercium était semblable au mercure, il devrait former un amalgame avec de l'or. Ce sera plutôt du radon, mais il tombera sur la glace. Aussi simple que puisse paraître l'expérience, elle n'a donné aucun résultat clair: les laboratoires individuels ont obtenu des résultats différents, la question reste donc ouverte.
De plus, selon ces études, il est encore plus volatil que le mercure et est même présent sous forme de gaz à la température ambiante. Si le système périodique continue à se développer, les nouveaux ajouts sont plus susceptibles de fournir des informations plus précises sur sa validité dans le cas de superéléments. Toutefois, la question dans un avenir prévisible n’a pas de signification pratique. Si le pouvoir de prédiction disparaît avec les numéros d'ordre les plus élevés, l'utilité de la table restante ne diminue pas. Et le chimiste typique ne devrait jamais traiter d'éléments très lourds.
Les premiers éléments de chaque période sont caractérisés par des atomes qui ont un électron à un niveau externe - ce sont des atomes de métaux alcalins. Les périodes se terminent par des atomes de gaz rares qui ont un niveau d'énergie externe complètement rempli d'électrons: les gaz inertes ont deux électrons dans la première période, les suivants - 8. C'est en raison de la structure similaire des couches d'électrons du groupe d'éléments qui ont des propriétés physico-chimiques similaires.
Étant donné que les représentants actuels ne peuvent être produits que dans les plus petites quantités et tombent en morceaux en quelques secondes, ils ne peuvent rien en faire. Cependant, d'après le modèle de noyau du noyau atomique, les éléments avec certains nombres «magiques» de protons et de neutrons, correspondant aux coques remplies, doivent être particulièrement stables. Il est exceptionnellement grand avec 2, 7 secondes. Cela conduit à une question plus générale, lorsque la liste des éléments se termine enfin. Selon l'opinion unanime de l'expert, aucun noyau atomique ne peut se former même pour un moment éphémère si le nombre de protons est trop important.
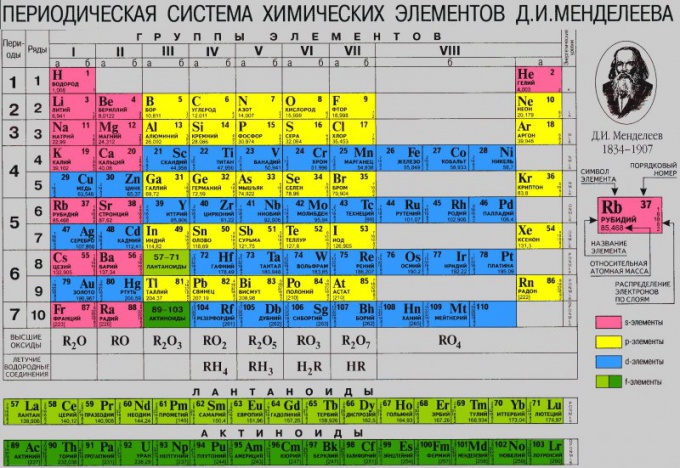
Dans le tableau D.I. Mendeleev a 8 sous-groupes principaux. Ce nombre est dû au nombre maximum possible d'électrons au niveau d'énergie.
Au bas du système périodique, les lanthanoïdes et les actinides sont identifiés comme des séries indépendantes.
Utilisation de la table D.I. Mendeleev peut observer la périodicité des propriétés suivantes des éléments: le rayon de l'atome, le volume de l'atome; potentiel d'ionisation; forces d'affinité aux électrons; électronégativité de l'atome; états d'oxydation; propriétés physiques des composés potentiels.
Mais où exactement la frontière, les points de vue divergent. Dans les calculs ponctuels, il semble se trouver avec l'élément 137. D'autres théoriciens estiment le volume réel du noyau 172 ou 173 pour l'élément le plus complexe. Cela laisse beaucoup de place à de nouvelles découvertes et, peut-être, à des noyaux relativement stables dont la chimie peut être étudiée. Pas plus que cela, la position dans le système périodique est susceptible de ne plus jouer aucun rôle.
Sur l'histoire du système périodique d'éléments prof. Et sans avertissement, «or élémental» signifie également «un atome d’or», qui ne peut pas avoir de point de fusion, ou pas de courant continu, qui n’a pas de couleur au sens où nous comprenons la couleur, mais qui ne produit de couleur que quand il est très grand le nombre d'atomes est formé dans les particules d'une substance ou d'une partie d'un matériau. Ensuite, l’or peut être rouge, vert ou jaune à la lumière du jour. La prise en compte des substances élémentaires a été au premier plan pendant un siècle, depuis que le système périodique d'éléments a été développé.
Par exemple, les rayons d'atomes, vus selon une période, diminuent de gauche à droite; grandir de haut en bas quand on le regarde en groupe.
Périodicité clairement traçable des éléments du tableau D.I. Mendeleev est rationnellement expliqué par la nature cohérente du remplissage des niveaux d'énergie par des électrons.
Sources:
Chaque substance élémentaire est composée d'au moins des atomes identiques. Ainsi, chaque atome de billard est un atome étranger. L'Anglais Robert Boyle peut être considéré comme le fondateur de la chimie moderne: il fut le premier à classer les acides en tant que substances transformant les teintures végétales bleues en rouge et en dissolvant le marbre. Les raisons peuvent annuler ce processus. Il a également affirmé de manière convaincante qu'il n'y avait pas quatre éléments - eau, terre, feu, air - mais bien plus que des éléments expliquant la diversité des substances et qu'il était nécessaire d'appeler ces substances unifiées qui ne pouvaient en aucun cas être transmises à deux autres substances différentes.
- Tableau périodique
Le droit périodique, qui est à la base de la chimie moderne et explique les schémas de modification des propriétés des éléments chimiques, a été découvert par D.I. Mendeleev en 1869. La signification physique de cette loi est révélée par l'étude de la structure complexe de l'atome.

On sait que l'eau produit de l'hydrogène et de l'oxygène à partir de chaux sodée et de dioxyde de carbone. Mais le soufre n'est toujours que gris, aussi haut qu'il chauffe ou coule, il tente également de s'électrolyser. Le sujet de ce congrès était la nomenclature des composés chimiques et leur présentation formelle, ainsi que la question des poids atomiques et moléculaires des composés chimiques. Mendeleev et Meyer ont tous deux développé leurs systèmes à partir d'une motivation didactique: pour donner un aperçu de l'abondance de toutes les substances déjà identifiées et non identifiées.
Au XIXe siècle, on croyait que la masse atomique était la principale caractéristique de l'élément, elle était donc utilisée pour classifier les substances. Maintenant, les atomes sont identifiés et identifiés par la magnitude de la charge de leur noyau (le nombre de protons et le nombre ordinal dans le tableau périodique). Cependant, la masse atomique des éléments, à quelques exceptions près (par exemple, la masse atomique du potassium est inférieure à la masse atomique de l'argon) augmente proportionnellement à leur charge nucléaire.
Dans la question encore plus profonde de savoir si les substances élémentaires pouvaient être reliées à la même matière d'origine, le "proto-heil" Mendeleev et Meyer étaient différents. Meyer, une hypothèse développée par l'Anglais William Prut, reposait sur le fait que toute la matière était finalement composée d'hydrogène très condensé, tandis que Mendeleev la contredisait sur la base d'incohérences dans les masses molaires de substances atomiques. À ce moment-là, Mendeleev et Meyer ne pouvaient pas savoir que, dans le domaine des micro-protons, neutrons et électrons, la loi de conservation de la masse ne pouvait plus être appliquée en raison de l'équivalence pondérale de la masse et de l'énergie.
Avec l'augmentation de la masse atomique, il se produit un changement périodique des propriétés des éléments et de leurs composés. Il s'agit de la métallicité et de la non métallicité des atomes, du rayon et du volume de l'atome, du potentiel d'ionisation, de l'affinité électronique, de l'électronégativité, des états d'oxydation, des propriétés physiques des composés (point d'ébullition, point de fusion, densité), de leur basicité, de leur amphotéricité ou de leur acidité.
Combien d'éléments dans le tableau périodique moderne
Le tableau périodique exprime graphiquement la loi périodique qui leur est révélée. Le système périodique moderne contient 112 éléments chimiques (ces derniers - Meitnerium, Darmstadtie, Roentgenium et Copernicia). Selon les dernières données, les 8 éléments suivants sont ouverts (jusqu'à 120 inclus), mais ils n'ont pas tous reçu leur nom et ces éléments sont encore peu nombreux dans lesquels des publications imprimées sont présentes.
Chaque élément occupe une cellule spécifique dans le système périodique et possède son propre numéro de séquence, correspondant à la charge du noyau de son atome.
Comment est construit le système périodique
La structure du système périodique est représentée par sept périodes, dix rangées et huit groupes. Chaque période commence par un métal alcalin et se termine par un gaz noble. Les exceptions sont la première période, à commencer par l'hydrogène, et la septième période incomplète.
Les périodes sont divisées en petites et grandes. Les petites périodes (première, deuxième, troisième) consistent en une rangée horizontale et les grandes périodes (quatrième, cinquième, sixième) se composent de deux rangées horizontales. Les rangées supérieures dans les grandes périodes sont appelées paires, les plus faibles - impaires.
Dans la sixième période du tableau après le lanthane (numéro ordinal 57), il y a 14 éléments présentant des propriétés similaires à celles du lanthane, les lanthanides. Ils sont placés dans la partie inférieure du tableau en tant que ligne séparée. Il en va de même pour les actinides, situés après l'actinium (portant le numéro 89) et répétant largement ses propriétés.
Même les rangées de grandes périodes (4, 6, 8, 10) ne sont remplies que de métaux.
Les éléments des groupes présentent la même valence plus élevée dans les oxydes et autres composés, et cette valence correspond au numéro du groupe. Les sous-groupes principaux contiennent des éléments de petites et de grandes périodes, uniquement de grande taille. De haut en bas, les propriétés métalliques sont améliorées, les propriétés non métalliques sont affaiblies. Tous les atomes des sous-groupes sont des métaux.
Lorsqu’il est chauffé, toute modification de cet élément chimique à une température supérieure à 220 ° C et son refroidissement ultérieur produisent du sélénium vitreux, il est fragile et présente un brillant vitreux.
Le sélénium gris hexagonal est le plus stable thermiquement, son réseau est constitué de chaînes d'atomes en spirale disposées parallèlement les unes aux autres. Il est obtenu en chauffant d'autres formes de sélénium avant la fusion et en le refroidissant lentement à 180-210 ° C. Dans les chaînes de sélénium hexagonal, les atomes sont liés de manière covalente.
Le sélénium est stable dans l'air, il n'agit pas: l'oxygène, l'eau, les acides sulfurique et chlorhydrique dilués, mais il est bien dissout dans l'acide nitrique. En interagissant avec les métaux, le sélénium forme des séléniures. Il existe de nombreux composés complexes du sélénium, ils sont tous toxiques.
Obtenez le sélénium de la production de vieux papiers ou de sulfate, la méthode de raffinage électrolytique du cuivre. Dans la boue, cet élément est présent avec les métaux lourds et nobles, le soufre et le tellure. Pour l'extraire, la boue est filtrée, puis chauffée avec de l'acide sulfurique concentré ou soumise à un grillage oxydant à une température de 700 ° C.

Instruction
Du latin, "calcium" est traduit par "chaux" ou "pierre tendre", et il doit sa découverte à l'Anglais Humphrey Davy, qui en 1808 fut capable d'isoler le calcium par voie électrolytique. Le scientifique a ensuite pris un mélange de chaux éteinte humide, "assaisonnée" avec de l'oxyde de mercure, et l'a soumis à un processus d'électrolyse sur une plaque de platine, qui apparaît dans l'expérience sous forme d'anode. La cathode était en fil métallique, que le chimiste a plongé dans du mercure liquide. Il est également intéressant de noter que des composés de calcium tels que le calcaire, le marbre et le gypse, ainsi que la chaux, étaient connus de l'homme pendant de nombreux siècles avant l'expérience Davy, au cours de laquelle les scientifiques considéraient certains d'entre eux comme des corps simples et indépendants. En 1789 seulement, le Français Lavoisier publia un ouvrage dans lequel il suggéra que la chaux, la silice, la baryte et l'alumine étaient des substances complexes.
Le calcium a un degré élevé d'activité chimique, c'est pourquoi il ne se produit presque pas dans la nature à l'état pur. Mais les scientifiques ont calculé que cet élément représente environ 3,38% de la masse totale de la croûte, ce qui fait du calcium le cinquième produit le plus utilisé après l’oxygène, le silicium, l’aluminium et le fer. Il y a cet élément dans l'eau de mer - environ 400 mg par litre. Le calcium fait également partie des silicates de diverses roches (granit et gneiss, par exemple). Une grande partie en feldspath, calcaire et calcaire, constituée de calcite minérale de formule CaCO3. La forme cristalline du calcium est le marbre. Au total, par la migration de cet élément dans la croûte, il forme 385 minéraux.
Les propriétés physiques du calcium comprennent sa capacité à présenter des capacités précieuses en semi-conducteurs, bien qu'il ne devienne pas un semi-conducteur et un métal au sens traditionnel du terme. Cette situation change avec une augmentation progressive de la pression, lorsque le calcium passe à un état métallique et à la capacité de présenter des propriétés supraconductrices. Le calcium interagit facilement avec l'oxygène, l'humidité de l'air et le dioxyde de carbone. C'est pourquoi, dans les laboratoires de travail, cet élément chimique est stocké dans des pots bien fermés.
Histoire du tableau périodique
Au milieu du XIXe siècle, les scientifiques ont pu découvrir soixante-trois éléments chimiques, mais il était impossible de construire une chaîne logique cohérente à partir de ceux-ci. Les éléments prévus pour être placés dans l'ordre de la masse atomique croissante et divisés par la similitude des propriétés chimiques en groupes.
Pour la première fois, le musicien et chimiste John Alexander Newland avait proposé sa théorie, semblable à la théorie future de Mendeleïev - mais la communauté scientifique a ignoré ses réalisations. La proposition de Newland n'a pas été prise au sérieux en raison de sa recherche d'harmonie et du lien entre musique et chimie.
Dimitri Mendeleïev a publié son tableau périodique en 1869 dans les pages du journal de la Société chimique russe. En outre, le scientifique a envoyé des notifications de sa découverte à tous les plus grands chimistes du monde, après quoi il a perfectionné et raffiné le tableau à plusieurs reprises, jusqu'à ce qu'il devienne ce qu'il est aujourd'hui. L’essence de la découverte de Dmitry Mendeleev était un changement périodique, plutôt que monotone, des propriétés chimiques des éléments à la masse atomique croissante. L'unification finale de la théorie en une loi périodique a eu lieu en 1871.
Légendes de Mendeleïev
La légende la plus commune est la découverte du tableau périodique dans un rêve. Le scientifique lui-même s'est moqué de ce mythe à plusieurs reprises, affirmant qu'il avait créé une table pendant de nombreuses années. Selon une autre légende, Dmitri Mendeleïev aurait inventé la vodka - elle est apparue après que les scientifiques eurent soutenu leur thèse intitulée «Discours sur la combinaison de l'alcool et de l'eau».
Mendeleev est toujours considéré par beaucoup comme le découvreur de la vodka, qui a elle-même aimé créer avec une solution hydro-alcoolique. Les contemporains du scientifique se moquaient souvent du laboratoire de Mendeleïev, qu’il avait équipé au creux d’un chêne géant.
La passion de Dmitry Mendeleïev pour le tissage de valises, dans laquelle le scientifique était engagé, résidait à Simferopol, était une raison distincte de ces rumeurs. À l'avenir, il fabriqua de ses propres mains des boîtes en carton pour les besoins de son laboratoire, pour lequel il était qualifié de caustique de maître des valises.
Le tableau périodique, en plus de la disposition des éléments chimiques dans un système unique, permettait de prédire la découverte de nombreux nouveaux éléments. Cependant, dans le même temps, certains d'entre eux ont été reconnus inexistants par les scientifiques, car ils étaient incompatibles avec le concept de loi périodique. L’histoire la plus célèbre à cette époque fut la découverte de nouveaux éléments tels que les coronies et les nébuleuses.
Bon conseil
Pour plus de commodité, il est préférable d’utiliser la version couleur du tableau.
Un système périodique est un ensemble ordonné d'éléments chimiques, leur classification naturelle, qui est une expression graphique (tabulaire) de la loi périodique des éléments chimiques. Sa structure, largement similaire à la structure moderne, a été développée par DI Mendeleev sur la base de la loi périodique de 1869–1871.
Le prototype du système périodique était "L'expérience d'un système d'éléments basé sur leur poids atomique et leur similarité chimique", compilée par DI Mendeleev le 1er mars 1869. Pendant deux ans et demi, le scientifique a continuellement amélioré "Expérience du système", a introduit l'idée de groupes, série et périodes d'éléments. En conséquence, la structure du système périodique a acquis de nombreuses manières des contours modernes.
Le concept de la place d'un élément dans le système, défini par des nombres de groupe et de période, est devenu important pour son évolution. Sur la base de ce concept, Mendeleev a conclu à la nécessité de modifier les masses atomiques de certains éléments: uranium, indium, cérium et ses satellites. Ce fut la première application pratique du système périodique. Mendeleev a également prédit pour la première fois l'existence et les propriétés de plusieurs éléments inconnus. Le scientifique a décrit en détail les propriétés les plus importantes de l’écaaluminium (futur gallium), de l’écabor (scandium) et de l’écacilicium (germanium). En outre, il a prédit l’existence d’analogues du manganèse (futur technétium et rhénium), du tellure (polonium), de l’iode (astatine), du césium (France), du baryum (radium), du tantale (protactinium). Les prédictions du scientifique concernant ces éléments étaient de nature générale, ces éléments étant situés dans des régions obscures du système périodique.
Les premières versions du système périodique ne représentaient, à bien des égards, qu’une généralisation empirique. Après tout, la signification physique de la loi périodique n’était pas claire, les raisons du changement périodique des propriétés des éléments dépendant de la croissance des masses atomiques n’étaient pas expliquées. À cet égard, de nombreux problèmes restaient en suspens. Y a-t-il des limites au système périodique? Est-il possible de déterminer le nombre exact d'éléments existants? La structure de la sixième période est restée incertaine - quelle est la quantité exacte d'éléments de terres rares? On ne savait pas s'il existait encore des éléments entre l'hydrogène et le lithium, quelle était la structure de la première période. Par conséquent, jusqu’à la justification physique du droit périodique et au développement de la théorie du système périodique, il s’est souvent heurté à de sérieuses difficultés. Une découverte inattendue était en 1894–1898. cinq gaz inertes, qui semblaient n'avoir aucune place dans le système périodique. Cette difficulté a été éliminée grâce à l’idée d’inclure dans la structure du système périodique un groupe zéro indépendant. La découverte massive d'éléments radio à la jonction des XIX et XX siècles. (en 1910, leur nombre était d'environ 40) a conduit à une contradiction flagrante entre la nécessité de les placer dans le système périodique et sa structure bien établie. Pour eux, il n'y avait que 7 postes vacants dans les sixième et septième périodes. Ce problème a été résolu grâce à l'établissement de règles pour le transfert et la découverte d'isotopes.
L’une des principales raisons de l’impossibilité d’expliquer la signification physique de la loi périodique et de la structure du système périodique était qu’on ignorait comment l’atome fonctionnait (voir Atome). La création du modèle atomique par E. Rutherford (1911) a constitué la principale étape du développement du système périodique. Sur sa base, le scientifique néerlandais A. Van den Broek (1913) a suggéré que le nombre ordinal d'un élément dans un système périodique est numériquement égal à la charge nucléaire de son atome (Z). Cela a été confirmé expérimentalement par le scientifique anglais G. Mosley (1913). La loi périodique recevait une justification physique: la périodicité des modifications des propriétés des éléments était considérée en fonction de la charge en Z du noyau de l'atome d'un élément et non de la masse atomique (voir Loi périodique des éléments chimiques).
En conséquence, la structure du système périodique est considérablement renforcée. La limite inférieure du système a été définie. Cet hydrogène est un élément avec un minimum de Z = 1. Il est devenu possible d'estimer avec précision le nombre d'éléments entre l'hydrogène et l'uranium. Les «lacunes» du système périodique ont été identifiées, correspondant à des éléments inconnus avec Z = 43, 61, 72, 75, 85, 87. Toutefois, les questions concernant le nombre exact d'éléments de terres rares demeuraient peu claires et, surtout, les raisons de la périodicité des modifications des propriétés des éléments n'ont pas été révélées. en fonction de Z.
Sur la base de la structure actuelle du système périodique et des résultats de l'étude des spectres atomiques, le scientifique danois N. Bor en 1918-1921. idées développées sur la séquence de construction des couches d'électrons et des sous-couches d'électrons dans les atomes. Le scientifique est parvenu à la conclusion que des types similaires de configurations électroniques des enveloppes extérieures des atomes se répètent périodiquement. Ainsi, il a été montré que la périodicité des modifications des propriétés des éléments chimiques s’explique par l’existence d’une périodicité dans la construction des couches de protection et des sous-couches d’électrons.
Le système périodique couvre plus de 100 éléments. Parmi ceux-ci, tous les éléments transuraniens (Z = 93 à 110), ainsi que les éléments avec Z = 43 (technétium), 61 (prométhium), 85 (astatine), 87 (France) sont obtenus artificiellement. Sur l’ensemble de l’historique du système périodique, un très grand nombre (\u003e 500) d’options de représentation graphique ont été proposées, principalement sous forme de tableaux, ainsi que sous différentes formes géométriques (spatiale et plane), des courbes analytiques (spirales, etc.), etc. Les plus courants sont les tables courtes, semi-longues, longues et en forme d’échelles. Actuellement, la forme abrégée est privilégiée.
Le principe fondamental de la construction d'un système périodique est sa division en groupes et en périodes. Le concept de série d'éléments de Mendeleïev n'est pas utilisé aujourd'hui, car il est dépourvu de sens physique. Les groupes, à leur tour, sont subdivisés en sous-groupes principaux (a) et secondaires (b). Chaque sous-groupe contient des éléments - des analogues chimiques. Les éléments des sous-groupes a et b de la plupart des groupes présentent également une certaine similitude entre eux, principalement dans les états d’oxydation les plus élevés, qui sont généralement égaux au nombre de groupes. Une période est un ensemble d'éléments qui commence par un métal alcalin et se termine par un gaz inerte (la première période est un cas particulier). Chaque période contient un nombre d'éléments strictement défini. Le système périodique comprend huit groupes et sept périodes, et la septième n'est pas encore terminée.
Caractéristique premier période est qu'il ne contient que 2 gazeux dans la forme libre de l'élément: l'hydrogène et l'hélium. La place de l'hydrogène dans le système est ambiguë. Comme il présente des propriétés communes aux métaux alcalins et aux halogènes, il est placé dans un sous-groupe 1a ou Vlla, ou les deux en même temps, en encadrant le symbole entre parenthèses dans l’un des sous-groupes. Helium est le premier représentant du sous-groupe VIIIa. Pendant longtemps, l'hélium et tous les gaz inertes ont été séparés en un groupe zéro indépendant. Cette situation a nécessité une révision après la synthèse des composés chimiques du krypton, du xénon et du radon. En conséquence, les gaz inertes et les éléments du groupe VIII précédent (fer, cobalt, nickel et platine) ont été combinés en un groupe.
La seconde période contient 8 éléments. Il commence par un lithium, un métal alcalin, dont le seul état d’oxydation est +1. Vient ensuite le béryllium (métal, degré d'oxydation +2). Bohr présente un caractère métallique faiblement prononcé et est un non-métal (degré d'oxydation +3). Le carbone qui suit le bore est un non-métal typique qui présente des états d’oxydation de +4 et -4. L'azote, l'oxygène, le fluor et le néon sont tous des non-métaux et l'azote a le degré d'oxydation le plus élevé +5 correspondant au numéro du groupe. L'oxygène et le fluor sont parmi les non-métaux les plus actifs. Un néon à gaz inerte complète la période.
Troisième la période (sodium - argon) contient également 8 éléments. La nature du changement de leurs propriétés est à bien des égards similaire à celle observée pour les éléments de la deuxième période. Mais il y a aussi sa spécificité. Ainsi, contrairement au béryllium, le magnésium est plus métallique que l'aluminium par rapport au bore. Le silicium, le phosphore, le soufre, le chlore, l'argon sont tous des non-métaux typiques. Et tous, à l'exception de l'argon, montrent les états d'oxydation les plus élevés, égaux au nombre de groupes.
Comme on le voit, dans les deux périodes, lorsque Z augmente, il se produit un net affaiblissement du métal et une augmentation des propriétés non métalliques des éléments. DI Mendeleïev a qualifié les éléments des deuxième et troisième périodes (selon ses termes, petits). Les éléments de petites périodes sont parmi les plus communs dans la nature. Le carbone, l’azote et l’oxygène (ainsi que l’hydrogène) sont des organogènes, c’est-à-dire les principaux éléments de la matière organique.
Tous les éléments de la première - la troisième période sont placés dans un - sous-groupe.
Le quatrième période (potassium - krypton) contient 18 éléments. Selon Mendeleev, c'est la première grande période. Après les métaux alcalins du potassium et des métaux alcalino-terreux, le calcium suit une série d'éléments consistant en 10 métaux de transition (scandium - zinc). Tous appartiennent à b - sous-groupes. La plupart des métaux de transition présentent des états d'oxydation plus élevés, égaux au nombre de groupes, à l'exception du fer, du cobalt et du nickel. Les éléments, commençant par le gallium et se terminant par le krypton, appartiennent à un sous-groupe. Un certain nombre de composés chimiques sont connus pour le krypton.
Cinquième période (rubidium - xénon) dans sa construction est similaire à la quatrième. Il contient également un insert de 10 métaux de transition (yttrium - cadmium). Les éléments de cette période ont leurs propres caractéristiques. Dans la triade ruthénium-rhodium-palladium, on connaît des composés du ruthénium, où il présente un état d'oxydation de +8. Tous les éléments d'un sous-groupe présentent des degrés d'oxydation plus élevés, égaux au nombre de groupes. Les particularités des modifications des propriétés des éléments des quatrième et cinquième périodes au fur et à mesure que Z grandit sont plus complexes que celles des deuxième et troisième périodes.
Sixième période (césium - radon) comprend 32 éléments. Pendant cette période, en plus des 10 métaux de transition (lanthane, hafnium - mercure), il existe également une combinaison de 14 lanthanides, du cérium au lutétium. Les éléments du cérium au lutétium sont chimiquement très similaires et, sur cette base, ils ont longtemps été inclus dans la famille des éléments des terres rares. Dans la forme abrégée du système périodique, la série de lanthanides est incluse dans la cellule de lanthane et l'interprétation de cette série est donnée au bas du tableau (voir Lanthanides).
Quelle est la spécificité des éléments de la sixième période? Dans la triade d’osmium - iridium - platine pour osmium, l’état d’oxydation est de +8. Astat a un caractère métallique assez prononcé. Le radon a la réactivité la plus élevée de tous les gaz inertes. Malheureusement, du fait de sa haute radioactivité, sa chimie a été peu étudiée (voir Eléments radioactifs).
Septième période commence par france. Comme le sixième, il devrait également contenir 32 éléments, mais on en connaît encore 24. La France et le radium sont respectivement des éléments des sous-groupes Ia et IIa, l'anémone appartient au sous-groupe IIIb. Vient ensuite la famille des actinides, qui comprend des éléments allant du thorium au lawrence, et est placée de la même manière que les lanthanides. Le décodage de cette série d’éléments est également indiqué au bas du tableau.
Voyons maintenant comment les propriétés des éléments chimiques dans sous-groupes système périodique. La principale caractéristique de ce changement est le renforcement du caractère métallique des éléments à mesure que Z augmente, tendance particulièrement marquée dans les sous-groupes IIIa-VIIa. Pour les sous-groupes de métaux Ia-IIIa, on observe une augmentation de l'activité chimique. Dans les sous-groupes d'éléments IVa-VIIa, lorsque Z augmente, on observe un affaiblissement de l'activité chimique des éléments. Pour les éléments des sous-groupes b, la nature des modifications de l'activité chimique est plus complexe.
La théorie du système périodique a été développée par N. Bohr et d’autres scientifiques dans les années 20. XX siècle. et est basé sur un schéma réel pour la formation de configurations électroniques d’atomes (voir Atome). Selon cette théorie, à mesure que Z grandit, le remplissage des coquilles d'électrons et des sous-coquilles dans les atomes d'éléments entrant dans les périodes du système périodique a lieu dans l'ordre suivant:
| Numéros de période | ||||||
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 1s | 2s2p | 3s3p | 4s3d4p | 5s4d5p | 6s4f5d6p | 7s5f6d7p |
Sur la base de la théorie des systèmes périodiques, on peut donner la définition suivante d’une période: une période est un ensemble d’éléments commençant par un élément de valeur n égale au nombre de périodes et l = 0 (s-éléments) et se terminant par un élément de même valeur de n et l = 1 (p- éléments) (voir Atome). L'exception est la première période contenant uniquement 1 - éléments. De la théorie du système périodique suivent le nombre d'éléments dans les périodes: 2, 8, 8, 18, 18, 32 ...
Dans le tableau, les symboles des éléments de chaque type (éléments s, p, d et f) sont représentés sur un fond de couleur spécifique: s - éléments - en rouge, éléments p - en orange, éléments d - en bleu, éléments f - sur le green. Chaque cellule contient les numéros de séquence et les masses atomiques des éléments, ainsi que les configurations électroniques des couches électroniques externes.
De la théorie du système périodique, il résulte que les sous-groupes a comprennent des éléments avec n égal au nombre de périodes, et l = 0 et 1. Les sous-groupes b comprennent les éléments dans les atomes desquels les coquilles sont terminées et qui étaient auparavant incomplètes. C'est pourquoi les première, deuxième et troisième périodes ne contiennent pas d'éléments de sous-groupes b.
La structure du système périodique d'éléments est étroitement liée à la structure des atomes d'éléments chimiques. Au fur et à mesure que Z augmente, des types de configuration similaires de couches électroniques externes se répètent périodiquement. À savoir, ils déterminent les principales caractéristiques du comportement chimique des éléments. Ces caractéristiques apparaissent différemment pour les éléments des sous-groupes a (éléments s et p), pour les éléments des sous-groupes b (éléments d transition) et pour les éléments des familles f - lanthanides et actinides. Le cas particulier est représenté par des éléments de la première période - hydrogène et hélium. L'hydrogène est caractérisé par une activité chimique élevée, car son seul électron - 1 est facilement dissociable. Dans le même temps, la configuration de l'hélium (1s 2) est très stable, ce qui entraîne son inactivité chimique.
Des éléments de sous-groupes remplissent les couches d'électrons externes d'atomes (avec n égal au nombre de périodes), donc les propriétés de ces éléments changent sensiblement à mesure que Z augmente.Ainsi, dans la seconde période, le lithium (configuration 2s) est un métal actif qui perd facilement un électron de valence. ; Le béryllium (2s 2) est également un métal, mais moins actif en raison du fait que ses électrons externes sont plus fortement liés au noyau. De plus, le bore (2s, 2p) a un caractère métallique faiblement prononcé, et tous les éléments ultérieurs de la deuxième période, dans lesquels se produit la construction de la sous-coque 2p, sont déjà des non-métaux. La configuration à huit électrons de la couche électronique externe du néon (2s 2 p 6) - gaz inerte - est très durable.
Les propriétés chimiques des éléments de la seconde période s’expliquent par le désir de leurs atomes d’acquérir la configuration électronique du gaz inerte le plus proche (configuration de l’hélium - éléments du lithium au carbone ou configuration du néon - éléments du carbone au fluor). C'est pourquoi, par exemple, l'oxygène ne peut pas présenter un degré d'oxydation plus élevé, égal au nombre de groupes: il est plus facile pour lui de réaliser la configuration au néon en acquérant des électrons supplémentaires. La même nature du changement de propriétés se manifeste dans les éléments de la troisième période et dans les éléments s et p de toutes les périodes ultérieures. En même temps, l'affaiblissement de la force de liaison des électrons externes avec le noyau de sous-groupes a mesure que Z augmente, se manifeste dans les propriétés des éléments correspondants. Ainsi, pour les éléments s, on observe une augmentation notable de l’activité chimique avec l’augmentation de Z, et pour les éléments p, une augmentation des propriétés métalliques.
Dans les atomes de transition d - éléments, les couches qui n’ont pas été complétées précédemment avec la valeur du nombre quantique principal n sont complétées, une de moins que le nombre de périodes. À quelques exceptions près, la configuration des couches externes d'électrons des atomes d'éléments de transition est ns 2. Par conséquent, tous les éléments d sont des métaux et c’est pourquoi les changements dans les propriétés des éléments d à mesure que Z grandit ne sont pas aussi nets que ceux observés pour les éléments s et p. Aux plus hauts degrés d'oxydation, les éléments d présentent une certaine similitude avec les éléments p des groupes correspondants du système périodique.
Les caractéristiques des propriétés des éléments des triades (VIIIb - sous-groupe) s’expliquent par le fait que les sous-coques b sont presque terminés. C’est pourquoi le fer, le cobalt, le nickel et le platine ne sont généralement pas enclins à donner des composés ayant des états d’oxydation plus élevés. Les seules exceptions sont le ruthénium et l'osmium, qui donnent les oxydes de RuO 4 et de OsO 4. Pour les éléments Ib– et IIb - sous-groupes, la sous-coque d est en réalité complète. Par conséquent, ils présentent des taux d'oxydation égaux au nombre de groupes.
Dans les atomes de lanthanides et d’actinides (tous des métaux), l’achèvement de couches électroniques précédemment incomplètes se produit avec le nombre quantique principal n deux unités inférieur au nombre de périodes. Dans les atomes de ces éléments, la configuration de la couche externe d'électrons (ns 2) reste inchangée et la troisième couche externe située à l'extérieur de la couche обол est remplie d'électrons 4f. C'est pourquoi les lanthanides sont si semblables.
En actinides, la situation est plus compliquée. Dans les atomes d'éléments avec Z = 90–95, les électrons 6d et 5f peuvent participer aux interactions chimiques. Par conséquent, les actinides ont beaucoup plus d'états d'oxydation. Par exemple, pour le neptunium, le plutonium et l’américium, on connaît des composés dans lesquels ces éléments apparaissent à l’état heptavalent. Seuls les éléments, à commencer par le curium (Z = 96), deviennent un état trivalent stable, mais même dans ce cas, il existe certaines particularités. Ainsi, les propriétés des actinides sont significativement différentes de celles des lanthanides et les deux familles ne peuvent donc pas être considérées comme similaires.
La famille des actinides se termine par un élément avec Z = 103 (Lawrence). L'évaluation des propriétés chimiques de Kurchatovia (Z = 104) et de Nilsborr (Z = 105) montre que ces éléments devraient être des analogues de l'hafnium et du tantale, respectivement. Par conséquent, les scientifiques pensent qu'après le passage de la famille des actinides dans les atomes, le remplissage systématique de la sous-coque 6d commence. L'évaluation de la nature chimique des éléments avec Z = 106–110 n'a pas été réalisée expérimentalement.
Le nombre fini d'éléments couverts par le système périodique est inconnu. Le problème de sa limite supérieure est peut-être le principal mystère du système périodique. L'élément le plus lourd trouvé dans la nature est le plutonium (Z = 94). La limite atteinte de la fusion nucléaire artificielle est l’élément portant le numéro de série 110. La question demeure: sera-t-il possible d’obtenir des éléments avec de grands numéros de séquence, lesquels et combien? Il n'est pas possible d'y répondre définitivement.
À l'aide des calculs les plus compliqués effectués sur des ordinateurs électroniques, les scientifiques ont tenté de déterminer la structure des atomes et d'évaluer les propriétés les plus importantes des "super-éléments", jusqu'à des nombres de séquence énormes (Z = 172 et même Z = 184). Les résultats étaient très inattendus. Par exemple, dans un atome d'un élément avec Z = 121, un électron 8p devrait apparaître; c'est après la formation d'une sous-couche 8s complétée en atomes avec Z = 119 et 120. Mais on n'observe l'apparition des électrons p après les électrons s que dans les atomes des éléments des deuxième et troisième périodes. Les calculs montrent également que, pour les éléments de la huitième période hypothétique, le remplissage des coquilles d'électrons et des sous-coquilles d'atomes se produit dans une séquence très complexe et particulière. Par conséquent, évaluer les propriétés des éléments correspondants est un problème très complexe. Il semblerait que la huitième période devrait contenir 50 éléments (Z = 119-168), mais, selon les calculs, elle devrait se terminer par un élément avec Z = 164, soit 4 numéros de série plus tôt. Et la neuvième période «exotique» devrait se composer de 8 éléments. Voici son enregistrement "électronique": 9s 2 8p 4 9p 2. En d'autres termes, il contiendrait un total de 8 éléments, comme les deuxième et troisième périodes.
Il est difficile de dire à quel point les calculs effectués à l'aide d'un ordinateur correspondraient à la vérité. Toutefois, si elles étaient confirmées, il faudrait revoir sérieusement les lois sous-jacentes au système périodique d'éléments et à sa structure.
Le système périodique a joué et continue de jouer un rôle énorme dans le développement de divers domaines des sciences naturelles. Il s’agissait de l’atout le plus important de la théorie de la molécule atomique, qui a contribué à l’émergence du concept moderne d ’" élément chimique "et à l’affinement des concepts de substances et de composés simples.
Les modèles révélés par le système périodique ont eu un impact significatif sur le développement de la théorie de la structure des atomes, la découverte d'isotopes, l'apparition d'idées sur la périodicité nucléaire. Une formulation strictement scientifique du problème de la prévision en chimie est associée au système périodique. Cela s'est manifesté par la prédiction de l'existence et des propriétés d'éléments inconnus et de nouvelles caractéristiques du comportement chimique des éléments déjà ouverts. Maintenant, le système périodique représente le fondement de la chimie, principalement inorganique, contribuant de manière significative à résoudre le problème de la synthèse chimique de substances aux propriétés prédéterminées, du développement de nouveaux matériaux semi-conducteurs, du choix de catalyseurs spécifiques pour divers processus chimiques, etc. Enfin, le système périodique est la base de l'enseignement la chimie
