Періодична система Менделєєва таблиця. Галогени і благородні гази.
Інструкція
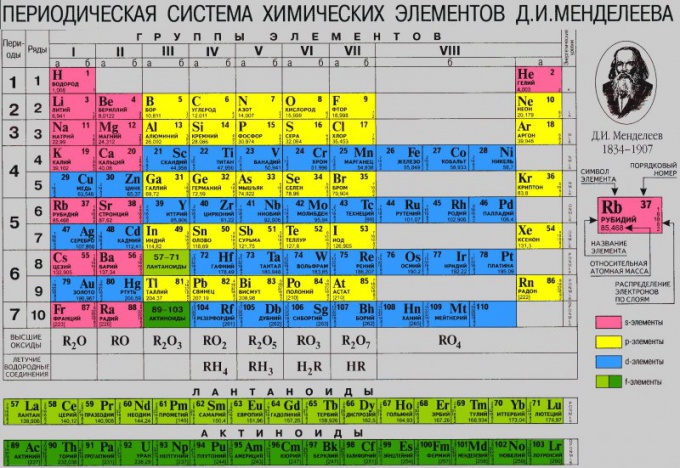
Періодична система являє собою багатоповерховий «будинок», в якому розташовується велика кількість квартир. Кожен «мешканець» або хімічний елемент живе у своїй власній квартирі під певним номером, який є постійним. Крім цього елемент має «прізвище» або назва, наприклад кисень, бор або азот. Крім цих даних в кожній «квартирі» або клітці вказана така інформація, як відносна атомна маса, яка може мати точні або округлені значення.
Тривожні ефекти відносності
Якби були синтезовані додаткові елементи, вони були б в новій серії системи. Дев'ять в числі, вони пропонують місця для ще двох електронів, як і раніше, - тому в цілому період буде відповідно затягнуть, а періодична система розшириться до 50 стовпців; Однак хіміки вже розробили більш компактні уявлення для такої широкої таблиці. 
Повна періодична система, ряди якої повністю заповнені, може з'явитися як остаточне виконання мрії Менделєєва. І якби це було так, не було б особливої риси Альберта Ейнштейна і його спеціальної теорії відносності.
Як в будь-якому будинку, тут є «під'їзди», а саме групи. Причому в групах елементи розташовуються зліва і справа, утворюючи підгрупи. Залежно від того, з якого боку їх більше, та підгрупа називається головною. Інша підгрупа, відповідно, буде побічної. Також в таблиці є «поверхи» або періоди. Причому періоди можуть бути як великими (складаються з двох рядів) так і малими (мають тільки один ряд).
У міру збільшення кількості елементів позитивний протон в ядрі збільшує його позитивний електричний заряд. У той же час його електростатичне тяжіння зростає на негативно заряджених електронах. Тому вони сильно прискорюються, коли вони наближаються до ядра. Це призводить до того, що електрони на внутрішніх орбиталях при високих порядках так швидко наближаються до швидкості світла. В результаті ефекти цього все частіше застосовуються. Наприклад, маса електронів збільшується, поки час розтягується.
Це скорочує орбиталь, особливо внутрішню, але в меншій мірі зовнішню, і стабілізує її в один і той же час. Все це називається прямим релятивістським ефектом. Однак теорія відносності також виробляє непрямі ефекти, які протидіють їм. У міру наближення внутрішніх електронів до ядра вони сильніше екранують свій заряд. Це зменшує електростатичне тяжіння зовнішніх електронів, в результаті чого розширюються орбіталі вищих оболонок.
По таблиці можна показати будову атома елемента, кожен з яких має позитивно заряджене ядро, що складається з протонів і нейтронів, а також обертаються навколо нього негативно заряджених електронів. Число протонів і електронів чисельно збігається і визначається в таблиці по порядковому номеру елемента. Наприклад, хімічний елемент сірка має №16, отже, буде мати 16 протонів і 16 електронів.
Все це навіть відчувається частково в повсякденному житті. Таким чином, релятивістські ефекти змушують ртуть як єдиний метал бути рідким. Вони також надають золоту свій жовтуватий колір, а срібло, яке перебуває прямо над ним в періодичній системі, виглядає біло-блакитним. Якщо фотон з правильною довжиною хвилі потрапляє на атом перехідного металу, він поглинається. У разі срібла енергетична щілину між двома орбиталями досить велика, так що для цього переходу потрібно фотон з ультрафіолетової області спектра.
Тому енергозберігаючий видиме світло просто відбивається, тому метал діє як ідеальне дзеркало для людського ока. Тому фотонів з синього спектрального діапазону досить, щоб підняти електрон. З іншого боку, світло всіх інших кольорів як і раніше недостатньо енергійний. Так що він все ще відскакує, тому ми бачимо білий мінус синього світла, який дає характерний золотисто-жовтий колір. До номера 118 всі елементи тепер відомі. Таким чином, періодична система повна в її нинішньому вигляді.
Щоб визначити кількість нейтронів (нейтральних частинок, також розташованих в ядрі) відніміть з відносною атомною маси елемента його порядковий номер. Наприклад, залізо має відносну атомну масу рівну 56 і порядковий номер 26. Отже, 56 - 26 = 30 протонів у заліза.
Електрони знаходяться на різній відстані від ядра, утворюючи електронні рівні. Щоб визначити число електронних (або енергетичних) рівнів, потрібно подивитися на номер періоду, в якому розташовується елемент. Наприклад, алюміній знаходиться в 3 періоді, отже, у нього буде 3 рівня.
Якби були додані додаткові елементи, для них необхідно було створити нову серію. Пекка Пиккё з Гельсінського університету та інші передбачили подальші релятивістські ефекти в золоті, в тому числі той факт, що він міг би з'єднатися з іншими атомами дивним чином. Не менш екзотична - це сферична молекула, в якій атом вольфраму оточений дванадцятьма атомами золота. Це з'єднання має ту ж структуру, що і відомий футбольний фуллерен, що складається з 60 атомів вуглецю, і спонтанно утворюється при випаровуванні вольфраму і золота в атмосфері захисного газу гелію.
За номером групи (але тільки для головної підгрупи) можна визначити вищу валентність. Наприклад, елементи першої групи головної підгрупи (літій, натрій, калій і т.д.) мають валентність 1. Відповідно, елементи другої групи (берилій, магній, кальцій і т.д.) будуть мати валентність рівну 2.
Також по таблиці можна проаналізувати властивості елементів. Зліва направо металеві властивості слабшають, а неметалічні посилюються. Це добре видно на прикладі 2 періоду: починається лужним металом натрієм, потім лужноземельний метал магній, після нього амфотерний елемент алюміній, потім неметали кремній, фосфор, сірка і закінчується період газоподібними речовинами - хлором і аргоном. У наступному періоді спостерігається аналогічна залежність.
Релятивістські квантово-механічні розрахунки також виявилися незамінними при відповіді на питання про те, як крихітні шматки атомів золота діють як каталізатори, так що вони розкладають токсичні речовини в вихлопних газах автомобілів, хоча дорогоцінний метал зазвичай не дуже добре реагує.
Незважаючи на такі релятивістські ефекти, відхилення від очікуваного характеру цього елемента все ще обмежені. Навіть актиноїди з їх набагато вищими порядковими числами мають в загальному властивості, відповідні їх положенню в періодичній системі. Дійсно погані, але і цікаві - сюрпризи виявилися тільки в недавно створених важких елементах. Їх хімія, наскільки це видно з попередніх тестів, вказує на серйозні тріщини в журналі.
Зверху вниз також спостерігається закономірність - металеві властивості посилюються, а неметалічні слабшають. Тобто, наприклад, цезій набагато активніше в порівнянні з натрієм.
Відкриття періодичного закону та створення впорядкованої системи хімічних елементів Д.І. Менделєєвим стали апогеєм розвитку хімії в XIX столітті. Вченим був узагальнений і систематизований великий матеріал знань про властивості елементів.
Фізики можуть стріляти важкими ядрами в прискорювачах частинок, щоб вони зливалися разом і утворювали елементи «суперелевера» - один з них з порядковими числами. Перші два були Рутерфорд і Дубно. Аналогічно, в Дубні з п'ятої підгрупи є докази того, що він веде себе як ще більш активний актіноідний протактиний.
Однак, відповідно до закону періоду, обидва вони повинні були бути схожими за своїми хімічними властивостями з елементами безпосередньо над ними, тобто гафнію і танталом. У цих умовах неможливо досліджувати їх хімічні властивості за допомогою традиційної «мокрою» хімії - зібрати їх в розчиненої формі з потенційними партнерами по реакції і подивитися, що станеться.
Інструкція
У XIX столітті не було жодних уявлень про будову атома. Відкриття Д.І. Менделєєва було лише узагальненням дослідних фактів, але їх фізичний зміст довгий час залишався незрозумілим. Коли з'явилися перші дані про будову ядра і розподілі електронів в атомах, це дозволило поглянути на періодичний закон і систему елементів по-новому. Таблиця Д.І. Менделєєва дає можливість наочно простежити періодичність властивостей елементів, що зустрічаються в природі.
Проте, дослідники розробили складні методи вивчення хімії цих елементів на окремих атомах. У таких експериментах Сіборгіум і Боріум знову показали хімічні властивості, які відповідали їх положенню в періодичній системі. Щоб прояснити це, дослідницькі групи також синтезували деякі важкі нестійкі ізотопи двох порівняльних елементів. Причина полягала в тому, що їх можна було виробляти і досліджувати так само, як і коперніцій. В результаті результати експериментів були краще в порівнянні з макроскопічними властивостями більш частих природних ізотопів.
Кожному елементу в таблиці ідентифікації абонента порядковий номер (H - 1, Li - 2, Be - 3 і т.д.). Цей номер відповідає заряду ядра (кількості протонів в ядрі) і числу електронів, що обертаються навколо ядра. Число протонів, таким чином, дорівнює числу електронів, і це говорить про те, що в звичайних умовах атом електрично нейтральний.
Розподіл на сім періодів відбувається по числу енергетичних рівнів атома. Атоми першого періоду мають однорівневу електронну оболонку, другого - дворівневу, третього - трирівневу і т.д. При заповненні нового енергетичного рівня починається новий період.
В експериментах свіжоспечені атоми осідали на поверхні, яка охолоджувалася до дуже низьких температур і частково покривалася золотом, частково льодом. Якщо коперніцій був схожий на ртуть, він повинен утворювати амальгаму з золотом. Швидше, це буде радон, але замість цього він впаде на лід. Як би не був простий, експеримент звучить, він не дав ніяких ясних результатів: окремі лабораторії отримали різні результати, тому питання залишається відкритим.
Більш того, згідно з цим дослідженням, він ще більш летючий, ніж ртуть, і навіть присутній у вигляді газу при кімнатній температурі. Якщо періодична система продовжує рости, нові доповнення, швидше за все, нададуть більш точну інформацію про її обгрунтованості у разі суперелементов. Однак питання в доступному для огляду майбутньому не має практичного значення. Якщо сила передбачення зникає з номерами найвищого порядку, корисність залишилася таблиці не зменшується. І типовий хімік ніколи не повинен мати справу з надважкими елементами.
Перші елементи всякого періоду характеризуються атомами, що мають по одному електрону на зовнішньому рівні, - це атоми лужних металів. Закінчуються періоди атомами інертних газів, що мають повністю заповнений електронами зовнішній енергетичний рівень: в першому періоді інертні гази мають 2 електрони, в наступних - 8. Саме через схожого будови електронних оболонок групи елементів мають подібні фізико-хімічні властивості.
Оскільки нинішні представники можуть проводитися тільки в найдрібніших кількостях і зазвичай розпадаються за лічені секунди, вони нічого не можуть з ними поробити. Однак з оболочечной моделі атомного ядра елементи з певними «магічними» числами протонів і нейтронів, відповідні заповненим оболонок, повинні бути особливо стійкими. Він надзвичайно великий з 2, 7 секунди. Це призводить до більш загального питання, коли список елементів, нарешті, закінчиться. Згідно одностайної думки експерта, ніякі атомні ядра не можуть утворюватися навіть протягом короткого часу, якщо число протонів занадто велике.
У таблиці Д.І. Менделєєва присутній 8 головних підгруп. Таке їх кількість обумовлена максимально можливим числом електронів на енергетичному рівні.
Внизу періодичної системи виділені лантаноїди і актиноїди в якості самостійних рядів.
За допомогою таблиці Д.І. Менделєєва можна поспостерігати періодичність наступних властивостей елементів: радіуса атома, обсягу атома; потенціалу іонізації; сили спорідненості з електроном; електронегативності атома; ступеня окислення; фізичних властивостей потенційних сполук.
Але де саме межа, погляди розходяться. У розрахунках з точковим сердечником він, як видається, лежить з елементом 137. Інші теоретики оцінюють фактичний обсяг ядра 172 або 173 для найбільш складного елемента. Це залишає багато місця для нових відкриттів і, можливо, відносно стабільних ядер, чия хімія може бути досліджена. Не більше того, положення в періодичній системі, ймовірно, більше не буде грати ніякої ролі.
Про історію періодичної системи елементів Проф. І без попередження, «елементне золото» також означає «атом золота», який не може мати точку плавлення, або не направляти ток, який не має кольору в тому сенсі, що ми розуміємо колір, а скоріше виробляє колір тільки тоді, коли дуже велика кількість атомів утворюється в частинках речовини або частини матеріалу. Тоді золото може бути червоного або зеленого або жовтого кольору, якщо дивитися в денний час. Розгляд елементарних речовин стояло на передньому плані в столітті, так як була розроблена періодична система елементів.
Наприклад, радіуси атомів, якщо дивитися вздовж періоду, зменшуються зліва направо; ростуть зверху вниз, якщо дивитися вздовж групи.
Чітко простежується періодичність розташування елементів в таблиці Д.І. Менделєєва раціонально пояснюється послідовним характером заповнення електронами енергетичних рівнів.
джерела:
Кожне елементарне речовина, в принципі, по крайней мере складається з однакових атомів. Таким чином, кожен більярдний атом є іноземним атомом. Англійця Роберта Бойля можна вважати засновником сучасної хімії: він першим класифікував кислоти як речовини, які перетворюють сині рослинні барвники в червоні і розчиняють мармур. Підстави можуть скасувати цей процес. Він також переконливо стверджував, що не було чотирьох елементів - води, землі, вогню, повітря, - але набагато більше елементів, що пояснюють різноманітність речовин, і що потрібно називати ті уніфіковані речовини, які Ні в якому разі не можна переходити на два різних інших речовини.
- таблиця Менделєєва
Періодичний закон, який є основою сучасної хімії і пояснює закономірності зміни властивостей хімічних елементів, був відкритий Д.І. Менделєєвим в 1869 році. Фізичний зміст цього закону розкривається при вивченні складної будови атома.

Відомо, що вода виробляє водень плюс кисень, з кальцинованої вапна плюс вуглекислоту. Але сірка завжди залишається тільки сірою, настільки високою, наскільки вона нагрівається або так стікає, її також намагаються електролізіровать. Предметом цього конгресу була номенклатура хімічних сполук і їх формальне подання, а також питання про атомних і молекулярних терезах хімічних сполук. І Менделєєв, і Мейер розробили свої системи з дидактичної мотивації: дати огляд достатку всіх речовин, які вже були ідентифіковані і які ще належить ідентифікувати.
У XIX столітті вважалося, що атомна маса є головною характеристикою елемента, тому для класифікації речовин використовували саме її. Зараз атоми визначають і ідентифікують за величиною заряду їх ядра (числу протонів і порядковому номеру в таблиці Менделєєва). Втім, атомна маса елементів за деякими винятками (наприклад, атомна маса калію менше атомної маси аргону) збільшується пропорційно їх заряду ядра.
У ще більш глибокому питанні про те, чи не можна простежити елементарні речовини до однієї початкової матерії, «прото-Хайл», Менделєєв і Мейер відрізнялися. Мейер, гіпотеза, розроблена англійцем Вільямом Прутом, залежала від того, що вся матерія була в кінцевому підсумку складена з сильно конденсованого водню, тоді як Менделєєв суперечив їй на основі невідповідностей в молярних масах атомних речовин. І Менделєєв, і Мейер в той час не могли знати, що в мікродіапазоне протонів, нейтронів і електронів закон збереження маси не може застосовуватися через ваговій еквівалентності маси і енергії.
При збільшенні атомної маси спостерігається періодична зміна властивостей елементів і їх сполук. Це Металічність і неметаллічность атомів, атомний радіус і обсяг, потенціал іонізації, спорідненість до електрону, електронегативність, ступеня окислення, фізичні властивості сполук (температури кипіння, плавлення, щільність), їх основність, амфотерность або кислотність.
Скільки елементів в сучасній таблиці Менделєєва
Таблиця Менделєєва графічно виражає відкритий ним періодичний закон. У сучасній періодичній системі міститься 112 хімічних елементів (останні - мейтнерій, Дармштадті, рентгеном і коперніцій). За останніми даними, відкриті і наступні 8 елементів (до 120 включно), але не всі з них отримали свої назви, і ці елементи поки ще мало в яких друкованих виданнях присутні.
Кожен елемент займає певну клітину в періодичній системі і має свій порядковий номер, що відповідає заряду ядра його атома.
Як побудована періодична система
Структура періодичної системи представлена сімома періодами, десятьма рядами і вісьмома групами. Кожен період починається лужним металом і закінчується благородним газом. Винятки становлять перший період, що починається воднем, і сьомий незавершений період.
Періоди діляться на малі і великі. Малі періоди (перший, другий, третій) складаються з одного горизонтального ряду, великі (четвертий, п'ятий, шостий) - з двох горизонтальних рядів. Верхні ряди в великих періодах називаються парними, нижні - непарними.
У шостому періоді таблиці після лантану (порядковий номер 57) знаходяться 14 елементів, схожих за властивостями на лантан, - лантаноїдів. Вони винесені в нижню частину таблиці окремим рядком. Те ж саме відноситься і до актиноїдів, розташованим після актинія (з номером 89) і багато в чому повторює його властивості.
Парні ряди великих періодів (4, 6, 8, 10) заповнені тільки металами.
Елементи в групах виявляють однакову вищу валентність в оксидах і інших з'єднаннях, і ця валентність відповідає номеру групи. Головні підгрупи вміщають в себе елементи малих і великих періодів, побічні - тільки великих. Зверху вниз металеві властивості посилюються, неметалічні - слабшають. Всі атоми побічних підгруп - метали.
При нагріванні будь-якої модифікації цього хімічного елемента вище 220 ° С і наступному охолодженні утворюється склоподібний селен, він крихкий і має скляним блиском.
Найбільш стійкий термічно гексагональний сірий селен, решітка якого побудована з розташованих паралельно один одному спіральних ланцюжків атомів. Його отримують за допомогою нагрівання інших форм селену до плавлення і повільним охолодженням до 180-210 ° С. Усередині ланцюгів гексагонального селену атоми пов'язані ковалентно.
Селен стійкий на повітрі, на нього не діють: кисень, вода, розбавлена сірчана і соляна кислоти, проте він добре розчиняється в азотній кислоті. Взаємодіючи з металами, селен утворює селеніди. Відомо безліч комплексних сполук селену, всі вони отруйні.
Отримують селен з відходів паперового або сірчанокислого виробництва, методом електролітичного рафінування міді. У шламах цей елемент присутній разом з важкими і благородними металами, сіркою і телуром. Для його отримання шлами фільтрують, потім нагрівають з концентрованої сірчаної кислотою або піддають окислювальному випалу при температурі 700 ° С.

Інструкція
З латинської мови «кальцій» перекладається як «вапно» або «м'який камінь», а своїм відкриттям він зобов'язаний англійцю Хемфрі Деві, який в 1808 році зміг виділити кальцій електролітичним методом. Вчений тоді взяв суміш вологою гашеного вапна, «приправлену» оксидом ртуті, і піддав її процесу електролізу на платинової пластині, яка фігурує в експерименті в якості анода. Катодом ж виступала дріт, яку хімік занурив в рідку ртуть. Цікаво й те, що такі сполуки кальцію, як вапняк, мармур і гіпс, а також вапно, були відомі людству за багато століть до експерименту Деві, протягом яких вчені вважали деякі з них простими і самостійними тілами. Тільки в 1789 році француз Лавуазьє опублікував працю, в якому він припустив, що вапно, кремнезем, барит і глинозем є складними речовинами.
Кальцій має високий ступінь хімічної активності, в силу чого в чистому вигляді в природі практично не зустрічається. Але вчені підрахували, що на частку цього елемента припадають близько 3,38% від загальної маси всієї земної кори, що робить кальцій п'ятим за поширеністю після кисню, кремній, алюмінію і заліза. Є цей елемент в морській воді - близько 400 мг на один літр. Входить кальцій і до складу силікатів різних гірських порід (наприклад, граніт і гнейси). Багато його в польовому шпату, крейді і вапняках, що складаються з мінералу кальциту з формулою СаСО3. Кристалічна форма кальцію - це мармур. У загальній же складності шляхом міграції цього елемента в земній корі він утворює 385 мінералів.
До фізичних властивостей кальцію відноситься його здатність проявляти цінні напівпровідникові здатності, хоча він і не стає напівпровідником і металом в традиційному сенсі цього слова. Змінюється дана ситуація при поступовому підвищенні тиску, коли кальцію повідомляється металевий стан і можливості прояву надпровідних властивостей. Легко взаємодіє кальцій з киснем, вологою повітря і вуглекислим газом, в силу чого в лабораторіях для роботи цей хімічний елемент зберігають в щільно закритих банках
Історія таблиці Менделєєва
До середини 19 століття вченим вдалося відкрити шістдесят три хімічні елементи, проте вибудувати з них струнку логічний ланцюжок ніяк не виходило. Елементи планувалося розмістити по порядку зростання атомної маси і розділити за подібністю хімічних властивостей на групи.
Вперше свою теорію, схожу з майбутньою теорією Менделєєва, запропонував музикант і хімік Джон Олександр Ньюленд - проте наукове співтовариство проігнорувало його досягнення. Пропозиція Ньюленда не прийняли всерйоз через його пошуків гармонії і зв'язку між музикою і хімією.
Дмитро Менделєєв вперше опублікував свою періодичну таблицю в 1869 році на сторінках журналу Російського хімічного суспільства. Також вчений розіслав повідомлення про своє відкриття всім провідним світовим хімікам, після чого він неодноразово поліпшував і допрацьовував таблицю, поки вона не стала такою, якою її знають сьогодні. Суть відкриття Дмитра Менделєєва полягала в періодичному, а не монотонній зміні хімічних властивостей елементів із зростанням атомної маси. Остаточне об'єднання теорії в періодичний закон сталося в 1871 році.
Легенди про Менделєєва
Найбільш поширеною легендою є відкриття таблиці Менделєєва уві сні. Сам вчений неодноразово висміював цей міф, стверджуючи, що він придумував таблицю протягом багатьох років. За іншою легендою Дмитро Менделєєв винайшов горілку - вона з'явилася після захисту вченим дисертації «Міркування про сполучення спирту з водою».
Менделєєва до сих пір багато хто вважає першовідкривачем горілки, який сам любив творити під водно-спиртовим розчином. Сучасники вченого часто посміювалися над лабораторією Менделєєва, яку той обладнав в дуплі гігантського дуба.
Окремим приводом для жартів з чуток була пристрасть Дмитра Менделєєва до плетіння валіз, яким учений займався, проживаючи в Сімферополі. Надалі він своїми руками майстрував контейнери з картону для потреб своєї лабораторії, за що його уїдливо називали майстром чемоданних справ.
Таблиця Менделєєва, крім упорядкування хімічних елементів в єдину систему, дала можливість передбачити відкриття багатьох нових елементів. Однак в той же час деякі з них вчені визнали неіснуючими, оскільки вони були несумісні з концепцією періодичного закону. Найбільш відомою історією на той момент було відкриття таких нових елементів, як короною і небуло.
Корисна порада
Для зручності краще використовувати кольоровий варіант таблиці.
Періодична система - впорядкована множина хімічних елементів, їх природна класифікація, яка є графічним (табличним) вираженням періодичного закону хімічних елементів. Структура її, багато в чому схожа з сучасною, розроблена Д. І. Менделєєвим на основі періодичного закону в 1869-1871 рр.
Прообразом періодичної системи був «Досвід системи елементів, заснованої на їхній атомній вазі і хімічній подібності», складений Д. І. Менделєєвим 1 березня 1869 г. На протязі двох з половиною років вчений безперервно удосконалював «Досвід системи», ввів уявлення про групи, рядах і періодах елементів. В результаті структура періодичної системи придбала багато в чому сучасні обриси.
Важливим для її еволюції стало поняття про місце елемента в системі, що визначається номерами групи і періоду. Спираючись на це поняття, Менделєєв прийшов до висновку, що необхідно змінити атомні маси деяких елементів: урану, індію, церію і його супутників. Це було перше практичне застосування періодичної системи. Менделєєв також вперше передбачив існування і властивості декількох невідомих елементів. Вчений детально описав найважливіші властивості екаалюмінієм (майбутнього галію), екабор (скандію) і екасіліція (германію). Крім того, він передбачив існування аналогів марганцю (майбутніх техніці і ренію), телуру (полонію), йоду (астату), цезію (франція), барію (радію), танталу (протактиния). Прогнози вченого щодо даних елементів носили загальний характер, оскільки ці елементи розташовувалися в маловивчених областях періодичної системи.
Перші варіанти періодичної системи багато в чому представляли лише емпіричне узагальнення. Адже був неясний фізичний сенс періодичного закону, було відсутнє пояснення причин періодичної зміни властивостей елементів залежно від зростання атомних мас. У зв'язку з цим залишалися невирішеними багато проблем. Чи є кордону періодичної системи? Чи можна визначити точну кількість існуючих елементів? Залишалася неясною структура шостого періоду - яке точну кількість рідкоземельних елементів? Було невідомо, чи існують ще елементи між воднем і літієм, яка структура першого періоду. Тому аж до фізичного обгрунтування періодичного закону і розробки теорії періодичної системи перед нею не раз виникали серйозні труднощі. Несподіваним було відкриття в 1894-1898 рр. п'яти інертних газів, яким, здавалося, не знаходилося місця в періодичній системі. Ця трудність була усунена завдяки ідеї включити в структуру періодичної системи самостійну нульову групу. Масове відкриття радіоелементів на стику XIX і XX ст. (На 1910 року їх число склало близько 40) призвело до різкого протиріччя між необхідністю їх розміщення в періодичній системі і її структурою, що склалася. Для них було тільки 7 вакантних місць в шостому і сьомому періодах. Ця проблема була вирішена в результаті встановлення правил зсуву і відкриття ізотопів.
Одна з головних причин неможливості пояснити фізичний зміст періодичного закону і структуру періодичної системи полягала в тому, що було невідомо, як влаштований атом (див. Атом). Найважливішою віхою на шляху розвитку періодичної системи стало створення атомної моделі Е. Резерфордом (1911). На її основі голландський учений А. Ван ден Брук (1913) висловив припущення, що порядковий номер елемента в періодичній системі чисельно дорівнює заряду ядра його атома (Z). Це експериментально підтвердив англійський учений Г. Мозлі (1913). Періодичний закон отримав фізичне обгрунтування: періодичність зміни властивостей елементів стала розглядатися в залежності від Z - заряду ядра атома елемента, а не від атомної маси (див. Періодичний закон хімічних елементів).
В результаті структура періодичної системи значно зміцнилася. Була визначена нижня межа системи. Це водень - елемент з мінімальним Z = 1. Стало можливим точно оцінити кількість елементів між воднем і ураном. Були визначені «прогалини» в періодичній системі, відповідні невідомим елементам з Z = 43, 61, 72, 75, 85, 87. Однак залишалися неясними питання про точну кількість рідкоземельних елементів і, що особливо важливо, що не були розкриті причини періодичності зміни властивостей елементів в залежності від Z.
Спираючись на сформовану структуру періодичної системи і результати вивчення атомних спектрів, датський вчений Н. Бор в 1918-1921 рр. розвинув уявлення про послідовність побудови електронних оболонок і подоболочек в атомах. Вчений дійшов висновку, що подібні типи електронних конфігурацій зовнішніх оболонок атомів періодично повторюються. Таким чином, було показано, що періодичність зміни властивостей хімічних елементів пояснюється існуванням періодичності в побудові електронних оболонок і подоболочек атомів.
Періодична система охоплює понад 100 елементів. З них все трансуранові елементи (Z = 93-110), а також елементи з Z = 43 (технецій), 61 (прометий), 85 (астат), 87 (Францій) отримані штучно. За всю історію існування періодичної системи було запропоновано дуже велика кількість (\u003e 500) варіантів її графічного зображення, переважно у вигляді таблиць, а також у вигляді різних геометричних фігур (просторових і площинних), аналітичних кривих (спіралей і ін.) І т. Д . Найбільшого поширення набули коротка, напівдовга, довга і сходова форми таблиць. В даний час перевага віддається короткої формі.
Фундаментальним принципом побудови періодичної системи є її підрозділ на групи і періоди. Менделєєвськая поняття рядів елементів нині не вживається, оскільки позбавлене фізичного змісту. Групи, в свою чергу, поділяються на головну (а) і побічну (Ь) підгрупи. У кожній підгрупі містяться елементи - хімічні аналоги. Елементи a- і b-підгруп в більшості груп також виявляють між собою певну схожість, головним чином у вищих ступенях окислення, які, як правило, рівні номеру групи. Періодом називається сукупність елементів, яка починається лужним металом і закінчується інертним газом (особливий випадок - перший період). Кожен період містить строго певну кількість елементів. Періодична система складається з восьми груп і семи періодів, причому сьомий період поки не завершений.
особливість першого періоду полягає в тому, що він містить всього 2 газоподібних у вільному вигляді елемента: водень і гелій. Місце водню в системі неоднозначно. Оскільки він проявляє властивості, загальні з лужними металами і з галогенами, то його поміщають або в 1a-, або в Vlla-підгрупу, або в обидві одночасно, укладаючи в одній з підгруп символ в дужки. Гелій - перший представник VIIIa-підгрупи. Довгий час гелій і все інертні гази виділяли в самостійну нульову групу. Це положення зажадало перегляду після синтезу хімічних сполук криптону, ксенону і радону. В результаті інертні гази та елементи колишньої VIII групи (залізо, кобальт, нікель і платинові метали) були об'єднані в рамках однієї групи.
другий період містить 8 елементів. Він починається лужним металом літієм, єдина ступінь окислення якого +1. Далі слід берилій (метал, ступінь окислення +2). Бор проявляє вже слабо виражений металевий характер і є неметаллом (ступінь окислення +3). Наступний за бором вуглець - типовий неметалл, який проявляє ступені окислення як +4, так і -4. Азот, кисень, фтор і неон - все неметали, причому у азоту вищий ступінь окислення +5 відповідає номеру групи. Кисень і фтор відносяться до найактивніших неметаллам. Інертний газ неон завершує період.
третій період (натрій - аргон) також містить 8 елементів. Характер зміни їх властивостей багато в чому аналогічний тому, який спостерігався для елементів другого періоду. Але тут є і своя специфіка. Так, магній на відміну від берилію більш металеві, так само як і алюміній в порівнянні з бором. Кремній, фосфор, сірка, хлор, аргон - все це типові неметали. І всі вони, крім аргону, проявляють вищі міри окислення, рівні номеру групи.
Як бачимо, в обох періодах у міру збільшення Z спостерігається виразне ослаблення металевих і посилення неметалічних властивостей елементів. Д. І. Менделєєв називав елементи другого і третього періодів (за його словами, малих) типовими. Елементи малих періодів належать до числа найбільш поширених в природі. Вуглець, азот і кисень (поряд з воднем) - органогени, т. Е. Основні елементи органічної матерії.
Всі елементи першого - третього періодів розміщуються в a-підгрупах.
четвертий період (калій - криптон) містить 18 елементів. За Менделєєву, це перший великий період. Після лужного металу калію і щелочноземельного металу кальцію слід ряд елементів, що складається з 10 так званих перехідних металів (скандій - цинк). Всі вони входять в b-підгрупи. Більшість перехідних металів виявляють вищі ступені окислення, рівні номеру групи, крім заліза, кобальту та нікелю. Елементи, починаючи з галію і закінчуючи криптоном, належать до а -подгруппам. Для криптону відомий ряд хімічних сполук.
п'ятий період (рубідій - ксенон) за своєю побудовою аналогічний четвертому. У ньому також міститься вставка з 10 перехідних металів (ітрій - кадмій). У елементів цього періоду є свої особливості. У тріаді рутеній - родій - паладій для рутенію відомі сполуки, де він проявляє ступінь окислення +8. Всі елементи a-підгруп виявляють вищі ступені окислення, рівні номеру групи. Особливості зміни властивостей у елементів четвертого і п'ятого періодів у міру зростання Z мають в порівнянні з другим і третім періодами більш складний характер.
шостий період (цезій - радон) включає 32 елемента. В цьому періоді крім 10 перехідних металів (лантан, гафній - ртуть) міститься ще й сукупність з 14 лантаноїдів - від церію до лютецію. Елементи від церію до лютецію хімічно дуже схожі, і на цій підставі їх давно включають в сімейство рідкоземельних елементів. У короткій формі періодичної системи ряд лантаноїдів включають в клітку лантану і розшифровку цього ряду дають внизу таблиці (див. Лантаноїди).
У чому полягає специфіка елементів шостого періоду? У тріаді осмій - іридій - платина для осмію відома ступінь окислення +8. Астат має досить виражений металевий характер. Радон володіє найбільшою реакційною здатністю з усіх інертних газів. На жаль, через те, що він сильно радіоактивний, його хімія мало вивчена (див. Радіоактивні елементи).
сьомий період починається з франція. Подібно шостому, він також повинен містити 32 елемента, але з них поки відомі 24. Францій і радій відповідно є елементами Ia- і IIa-підгруп, актиній належить до IIIb-підгрупі. Далі слід сімейство актиноїдів, яке включає елементи від торію до Лоуренса і розміщується аналогічно лантаноїдам. Розшифровка цього ряду елементів також дається внизу таблиці.
Тепер подивимося, як змінюються властивості хімічних елементів в підгрупах періодичної системи. Основна закономірність цього зміни полягає в посиленні металевого характеру елементів у міру зростання Z. Особливо чітко ця закономірність проявляється в IIIa-VIIa-підгрупах. Для металів Ia-IIIa-підгруп спостерігається зростання хімічної активності. У елементів IVa-VIIa-підгруп у міру збільшення Z спостерігається ослаблення хімічної активності елементів. У елементів b-підгруп характер зміни хімічної активності складніший.
Теорія періодичної системи була розроблена Н. Бором та іншими вченими в 20-х рр. XX ст. і заснована на реальній схемі формування електронних конфігурацій атомів (див. Атом). Відповідно до цієї теорії, у міру зростання Z заповнення електронних оболонок і подоболочек в атомах елементів, що входять в періоди періодичної системи, відбувається в такій послідовності:
| номери періодів | ||||||
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 1s | 2s2p | 3s3p | 4s3d4p | 5s4d5p | 6s4f5d6p | 7s5f6d7p |
На підставі теорії періодичної системи можна дати наступне визначення періоду: період є сукупність елементів, що починається елементом із значенням n, рівним номеру періоду, і l = 0 (s-елементи) і закінчується елементом з тим же значенням n і l = 1 (p- елементи) (див. Атом). Виняток становить перший період, який містить лише 1s-елементи. З теорії періодичної системи слідують числа елементів в періодах: 2, 8, 8, 18, 18, 32 ...
У таблиці символи елементів кожного типу (s-, p-, d- і f-елементи) зображені на певному колірному тлі: s-елементи - на червоному, p-елементи - на помаранчевому, d-елементи - на синьому, f-елементи - на зеленому. У кожній клітині наведені порядкові номери і атомні маси елементів, а також електронні конфігурації зовнішніх електронних оболонок.
З теорії періодичної системи слід, що до a -подгруппам належать елементи з n, рівним номеру періоду, і l = 0 і 1. До b -подгруппам відносяться ті елементи, в атомах яких відбувається добудова оболонок, раніше залишалися незавершеними. Саме тому перший, другий і третій періоди не містять елементів b-підгруп.
Структура періодичної системи елементів тісно пов'язана з будовою атомів хімічних елементів. У міру зростання Z періодично повторюються подібні типи конфігурації зовнішніх електронних оболонок. А саме вони визначають основні особливості хімічної поведінки елементів. Ці особливості по-різному проявляються для елементів a-підгруп (s- і р-елементи), для елементів b-підгруп (перехідні d-елементи) і елементів f-сімейств - лантаноїдів і актиноїдів. Особливий випадок представляють елементи першого періоду - водень і гелій. Для водню характерна висока хімічна активність, тому що його єдиний 1s-електрон легко відщеплюється. У той же час конфігурація гелію (1s 2) досить стійка, що обумовлює його хімічну бездіяльність.
У елементів а-підгруп відбувається заповнення зовнішніх електронних оболонок атомів (з n, рівним номеру періоду), тому властивості цих елементів помітно змінюються в міру зростання Z. Так, у другому періоді літій (конфігурація 2s) - активний метал, легко втрачає єдиний валентний електрон ; берилій (2s 2) - також метал, але менш активний внаслідок того, що його зовнішні електрони більш міцно пов'язані з ядром. Далі, бор (2s 2 p) має слабо виражений металевий характер, а всі наступні елементи другого періоду, у яких відбувається побудова 2p -подоболочки, є вже неметалами. Восьміелектронная конфігурація зовнішньої електронної оболонки неону (2s 2 p 6) - інертного газу - дуже міцна.
Хімічні властивості елементів другого періоду пояснюються прагненням їх атомів придбати електронну конфігурацію найближчого інертного газу (конфігурацію гелію - для елементів від літію до вуглецю або конфігурацію неону - для елементів від вуглецю до фтору). Ось чому, наприклад, кисень не може проявляти вищого рівня окислення, що дорівнює номеру групи: адже йому легше досягти конфігурації неону шляхом придбання додаткових електронів. Такий же характер зміни властивостей проявляється у елементів третього періоду і у s- і p-елементів всіх наступних періодів. У той же час ослаблення міцності зв'язку зовнішніх електронів з ядром в a-підгрупах зі зростанням Z проявляється у властивостях відповідних елементів. Так, для s-елементів відзначається помітне зростання хімічної активності в міру зростання Z, а для p-елементів - наростання металевих властивостей.
В атомах перехідних d-елементів добудовуються не завершені раніше оболонки зі значенням головного квантового числа n, на одиницю меншим номери періоду. За окремими винятками, конфігурація зовнішніх електронних оболонок атомів перехідних елементів - ns 2. Тому все d-елементи є металами, і саме тому зміни властивостей d-елементів у міру зростання Z не так різання, як це спостерігається у s- і p-елементів. У вищих ступенях окислення d-елементи проявляють певну схожість з p-елементами відповідних груп періодичної системи.
Особливості властивостей елементів тріад (VIIIb-підгрупа) пояснюються тим, що b-подоболочки близькі до завершення. Ось чому залізо, кобальт, нікель і платинові метали, як правило, не схильні давати з'єднання вищих ступенів окислення. Виняток становлять лише рутеній і осмій, що дають оксиди RuO 4 і OsO 4. У елементів Ib- і IIb-підгруп d-подоболочка фактично виявляється завершеною. Тому вони виявляють ступеня окислення, рівні номеру групи.
В атомах лантаноїдів і актиноїдів (всі вони метали) відбувається добудова раніше незавершених електронних оболонок зі значенням головного квантового числа n на дві одиниці менше номера періоду. В атомах цих елементів конфігурація зовнішньої електронної оболонки (ns 2) зберігається незмінною, а заповнюється третя зовні N-оболонка 4f-електронами. Ось чому лантаноїди так схожі.
У актиноидов справа йде складніше. В атомах елементів з Z = 90-95 електрони 6d і 5f можуть брати участь в хімічних взаємодіях. Тому актиноїди мають набагато більше ступенів окислення. Наприклад, для нептунію, плутонію і америцію відомі сполуки, де ці елементи виступають в семивалентном стані. Тільки у елементів, починаючи з кюрія (Z = 96), стає стійким трехвалентное стан, але і тут є свої особливості. Таким чином, властивості актиноїдів значно відрізняються від властивостей лантаноїдів, і обидва сімейства тому не можна вважати подібними.
Сімейство актиноидов закінчується елементом з Z = 103 (лоуренсій). Оцінка хімічних властивостей Курчатова (Z = 104) і нильсборий (Z = 105) показує, що ці елементи повинні бути аналогами відповідно гафнію і танталу. Тому вчені вважають, що після сімейства актиноїдів в атомах починається систематичне заповнення 6d -подоболочки. Оцінка хімічної природи елементів з Z = 106-110 експериментально не проводилася.
Кінцеве число елементів, яке охоплює періодична система, невідомо. Проблема її верхньої межі - це, мабуть, основна загадка періодичної системи. Найбільш важкий елемент, який вдалося виявити в природі, - це плутоній (Z = 94). Досягнутий межа штучного ядерного синтезу - елемент з порядковим номером 110. Залишається відкритим питання: чи вдасться отримати елементи з великими порядковими номерами, які і скільки? На нього не можна поки відповісти скільки-небудь виразно.
За допомогою складних розрахунків, виконаних на електронних обчислювальних машинах, вчені спробували визначити будову атомів і оцінити найважливіші властивості «сверхелементов», аж до величезних порядкових номерів (Z = 172 і навіть Z = 184). Отримані результати виявилися досить несподіваними. Наприклад, в атомі елемента з Z = 121 передбачається поява 8p-електрона; це після того, як в атомах з Z = 119 і 120 завершилося формування 8s -подоболочки. А адже поява p-електронів слідом за s-електронами спостерігається тільки в атомах елементів другого і третього періодів. Розрахунки показують також, що у елементів гіпотетичного восьмого періоду заповнення електронних оболонок і під-оболонок атомів відбувається в дуже складній і своєрідною послідовності. Тому оцінити властивості відповідних елементів - проблема вельми складна. Здавалося б, восьмий період повинен містити 50 елементів (Z = 119-168), але, згідно з розрахунками, він повинен завершуватися у елемента з Z = 164, т. Е. На 4 порядкових номери раніше. А «екзотичний» дев'ятий період, виявляється, має складатися з 8 елементів. Ось його «електронна» запис: 9s 2 8p 4 9p 2. Іншими словами, він містив би всього 8 елементів, як другий і третій періоди.
Важко сказати, наскільки відповідали б істині розрахунки, виконані за допомогою комп'ютера. Однак якби вони були підтверджені, то довелося б серйозно переглянути закономірності, що лежать в основі періодичної системи елементів і її структури.
Періодична система зіграла і продовжує грати величезну роль у розвитку різних областей природознавства. Вона стала найважливішим досягненням атомно-молекулярного вчення, сприяла появі сучасного поняття «хімічний елемент» і уточненню понять про простих речовинах і з'єднаннях.
Закономірності, розкриті періодичної системою, мали істотний вплив на розробку теорії будови атомів, відкриття ізотопів, поява уявлень про ядерну періодичності. З періодичної системою пов'язана строго наукова постановка проблеми прогнозування в хімії. Це проявилося в прогнозі існування і властивостей невідомих елементів і нових особливостей хімічної поведінки елементів вже відкритих. Нині періодична система являє фундамент хімії, в першу чергу неорганічної, істотно допомагаючи вирішення завдання хімічного синтезу речовин із заздалегідь заданими властивостями, розробці нових напівпровідникових матеріалів, підбору специфічних каталізаторів для різних хімічних процесів і т. Д. І нарешті, періодична система лежить в основі викладання хімії.
