Le système périodique de Mendeleev est nouveau. Le système périodique de Mendeleïev et la loi périodique.
Au cours du XIXe siècle, de nombreux domaines ont subi une forte réforme, notamment la chimie. Système périodique Mendeleev, formulé en 1869, a conduit à une compréhension unifiée de la dépendance de la position des substances simples dans le tableau périodique, qui a établi la relation entre la masse atomique relative, la valence et la propriété d'un élément.
Période domaniale de la chimie
Un peu plus tôt, au début du XIXe siècle, des tentatives répétées ont été faites pour systématiser le chimiste allemand Döbereiner a effectué le premier travail sérieux sur la systématisation dans le domaine de la chimie. Il a déterminé qu'un certain nombre de substances similaires dans leurs propriétés peuvent être combinées en groupes - triades.
Le sophisme des idées du scientifique allemand
L'essence de la loi des triades de Döbereiner présentée a été déterminée par le fait que la masse atomique de la substance souhaitée est proche de la demi-somme (valeur moyenne) des masses atomiques des deux derniers éléments du tableau des triades. Cependant, l'absence de magnésium dans un seul sous-groupe de calcium, strontium et baryum était erronée.
Cette approche était une conséquence de la limitation artificielle de substances similaires uniquement par des unions triples. Döbereiner a clairement vu la similitude dans les paramètres chimiques du phosphore et de l'arsenic, du bismuth et de l'antimoine. Cependant, il s'est limité à trouver des triades. En conséquence, il n'a pas pu arriver à la classification correcte des éléments chimiques.
Döbereiner n'a certainement pas réussi à diviser les éléments existants en triades, la loi a clairement indiqué la présence d'une relation entre et les propriétés des substances chimiques simples.
Le processus de systématisation des éléments chimiques
Toutes les tentatives ultérieures de systématisation reposaient sur la répartition des éléments en fonction de leur masse atomique. Plus tard, l'hypothèse de Döbereiner a été utilisée par d'autres chimistes. La formation de triades, tétrades et pentades (combinaison en groupes de trois, quatre et cinq éléments) est apparue.
Dans la seconde moitié du XIXe siècle, plusieurs travaux sont apparus simultanément, sur la base desquels Dmitry Ivanovich Mendeleev a conduit la chimie à une systématisation complète des éléments chimiques. La structure différente du système périodique de Mendeleev a conduit à une compréhension révolutionnaire et à une évidence du mécanisme de distribution des substances simples.
Tableau périodique des éléments de Mendeleev
Lors d'une réunion de la communauté chimique russe au printemps 1869, l'avis du scientifique russe D.I.Mendeleev concernant sa découverte de la loi périodique des éléments chimiques a été lu.  À la fin de la même année, le premier ouvrage "Les fondamentaux de la chimie" a été publié et le premier tableau périodique des éléments y a été inclus.
À la fin de la même année, le premier ouvrage "Les fondamentaux de la chimie" a été publié et le premier tableau périodique des éléments y a été inclus.
En novembre 1870, il montra à ses collègues le supplément « Le système naturel des éléments et son utilisation pour indiquer les qualités des éléments non découverts ». Dans cet ouvrage, D. I. Mendeleev a utilisé pour la première fois le terme « loi périodique". Le système d'éléments de Mendeleev, sur la base de la loi périodique, a déterminé la possibilité de l'existence de substances simples non ouvertes et a clairement indiqué leurs propriétés.
Corrections et précisions
En conséquence, en 1971, la loi périodique et les éléments de Mendeleev ont été finalisés et complétés par un chimiste russe.
Dans l'article final "Validité périodique des éléments chimiques", le scientifique a établi la définition de la loi périodique, qui indique que les caractéristiques des corps simples, les propriétés des composés, ainsi que les corps complexes formés par eux sont déterminés par dépendance directe selon à leur poids atomique.
Un peu plus tard, en 1872, la structure du système périodique de Mendeleev a été réorganisée sous une forme classique (méthode de distribution à courte période). 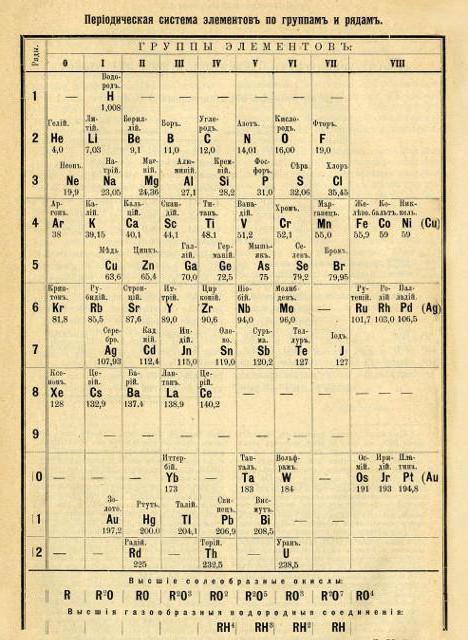
Contrairement à ses prédécesseurs, le chimiste russe a entièrement compilé un tableau, introduit le concept de la régularité du poids atomique des éléments chimiques.
Les caractéristiques des éléments du système périodique de Mendeleev et les régularités dérivées ont permis au scientifique de décrire les propriétés des éléments qui n'ont pas encore été découverts. Mendeleev s'est appuyé sur le fait que les propriétés de chaque substance peuvent être déterminées en fonction des caractéristiques de deux éléments voisins. Il l'appelait la règle des "étoiles". Son essence est que dans le tableau des éléments chimiques, pour déterminer les propriétés de l'élément sélectionné, il est nécessaire d'orienter horizontalement et verticalement dans le tableau des éléments chimiques.
capable de prévoir...
Le tableau périodique des éléments, malgré son exactitude et sa fidélité, n'était pas pleinement reconnu par la communauté scientifique. Certains grands scientifiques de renommée mondiale ont ouvertement ridiculisé la possibilité de prédire les propriétés d'un élément non découvert. Et ce n'est qu'en 1885, après la découverte des éléments prédits - ekaaluminium, ekabor et ekasilicium (gallium, scandium et germanium), que le nouveau système de classification de Mendeleev et la loi périodique ont été reconnus comme base théorique chimie.
Au début du XXe siècle, la structure du système périodique de Mendeleev a été corrigée à plusieurs reprises. Dans le processus d'obtention de nouvelles données scientifiques, D.I. Mendeleev et son collègue U. Ramzai sont arrivés à la conclusion qu'il était nécessaire d'introduire un groupe zéro. Il comprend les gaz inertes (hélium, néon, argon, krypton, xénon et radon).
En mil neuf cent onze, F. Soddy a proposé de placer des éléments chimiques indiscernables - les isotopes - dans une cellule du tableau.
Au cours d'un travail long et minutieux, le tableau du système périodique des éléments chimiques de Mendeleev a finalement été finalisé et a acquis un aspect moderne. Il comprenait huit groupes et sept périodes. Les groupes sont des colonnes verticales, les périodes sont horizontales. Les groupes sont divisés en sous-groupes. ![]()
La position d'un élément dans le tableau indique sa valence, ses électrons purs et ses caractéristiques chimiques. Comme il s'est avéré plus tard, lors du développement de la table, D.I. Mendeleev a découvert une coïncidence aléatoire du nombre d'électrons d'un élément avec son numéro de série. ![]() Ce fait a encore simplifié la compréhension du principe d'interaction des substances simples et de la formation de substances complexes. Et aussi le processus de direction inverse... Le calcul de la quantité de substance obtenue, ainsi que la quantité requise pour que la réaction chimique se déroule, est devenu théoriquement disponible.
Ce fait a encore simplifié la compréhension du principe d'interaction des substances simples et de la formation de substances complexes. Et aussi le processus de direction inverse... Le calcul de la quantité de substance obtenue, ainsi que la quantité requise pour que la réaction chimique se déroule, est devenu théoriquement disponible.
Le rôle de la découverte de Mendeleev dans la science moderne
Le système de Mendeleev et son approche de l'ordonnancement des éléments chimiques ont prédéterminé le développement ultérieur de la chimie. Grâce à une compréhension correcte de la relation entre les constantes chimiques et l'analyse, Mendeleev a pu organiser et grouper correctement les éléments en fonction de leurs propriétés.  La nouvelle table des éléments permet de calculer clairement et précisément les données avant le début d'une réaction chimique, de prédire de nouveaux éléments et leurs propriétés.
La nouvelle table des éléments permet de calculer clairement et précisément les données avant le début d'une réaction chimique, de prédire de nouveaux éléments et leurs propriétés.
La découverte du scientifique russe a eu un impact direct sur la suite du développement de la science et de la technologie. Il n'y a pas de domaine technologique qui n'implique des connaissances en chimie. Peut-être que si une telle découverte n'avait pas eu lieu, notre civilisation aurait suivi un chemin de développement différent.
À l'heure actuelle, il contient officiellement 118 produits chimiques. Parmi ceux-ci, 94 se trouvent dans la nature, les 24 restants sont obtenus artificiellement à la suite de réactions nucléaires. De tous les produits chimiques trouvés dans la nature, 88 ; des éléments tels que le technétium Tc, prométhium après-midi, astatine À et france Fr, ainsi que tous les éléments suivant l'uranium U, ont été obtenus artificiellement pour la première fois. Dans des conditions normales, les substances simples correspondantes pour 11 éléments sont des gaz, pour 2 - liquides, pour le reste des éléments - solides.
A lire
 Dmitri Ivanovitch Mendeleïev- Scientifique-encyclopédiste russe, personnalité publique. Chimiste, physicochimiste, physicien, métrologue, économiste, technologue, géologue, météorologue, enseignant, aéronaute, luthier. Professeur de l'Université de Saint-Pétersbourg; Membre correspondant de la catégorie "physique" de l'Académie impériale des sciences de Saint-Pétersbourg. Parmi les plus découvertes célèbres- la loi périodique des éléments chimiques, une des lois fondamentales de l'univers, inhérente à toute science naturelle.
Dmitri Ivanovitch Mendeleïev- Scientifique-encyclopédiste russe, personnalité publique. Chimiste, physicochimiste, physicien, métrologue, économiste, technologue, géologue, météorologue, enseignant, aéronaute, luthier. Professeur de l'Université de Saint-Pétersbourg; Membre correspondant de la catégorie "physique" de l'Académie impériale des sciences de Saint-Pétersbourg. Parmi les plus découvertes célèbres- la loi périodique des éléments chimiques, une des lois fondamentales de l'univers, inhérente à toute science naturelle.
Tableau périodique des éléments chimiques- la classification des éléments chimiques, qui établit la dépendance de diverses propriétés des éléments vis-à-vis de la charge du noyau atomique. Le système est une expression graphique de la loi périodique établie par le chimiste russe D.I. Mendeleïev en 1869. Sa version initiale a été développée par D.I. Mendeleev en 1869-1871 et a établi la dépendance des propriétés des éléments sur leur poids atomique. Au total, plusieurs centaines de variantes de l'image du système périodique ont été proposées. Dans la version moderne du système, on suppose que les éléments sont résumés dans un tableau à deux dimensions, dans lequel chaque colonne détermine les propriétés physico-chimiques de base et les lignes représentent des périodes quelque peu similaires les unes aux autres. Au milieu du 19ème siècle, 63 éléments chimiques avaient été découverts, et des tentatives pour trouver des modèles dans cet ensemble ont été faites à plusieurs reprises. Plus courantes que d'autres sont 3 formes du tableau périodique : "court", "long" et "extra-long". Dans la version « extra-longue », chaque point occupe exactement une ligne. Tableau périodique des D.I. Mendeleev est devenu le jalon le plus important dans le développement de la doctrine atomique-moléculaire.
Un nouvel élément a été ajouté au tableau périodique
Certaines des questions chimiques les plus populaires : « Combien d'éléments chimiques sont connus maintenant ? », « Combien y a-t-il d'éléments chimiques ? », « Qui les a découverts ? »
Ces questions n'ont pas de réponse simple et sans ambiguïté.
Que signifie « connu » ? Se trouvent-ils dans la nature ? Sur terre, dans l'eau, dans l'espace ? Leurs propriétés ont-elles été obtenues et étudiées ? Propriétés de quoi ? Substances sous forme de phases ou seulement au niveau atomique-moléculaire ? Disponible technologies modernes permettent de détecter plusieurs atomes... Mais, pour un seul atome, les propriétés d'une substance ne peuvent être déterminées.
Et que veut dire « exister » ? Concrètement, cela se comprend : ils sont présents dans la nature en quantité et depuis si longtemps qu'eux et leurs composés peuvent avoir un réel impact sur les phénomènes naturels. Ou du moins, vous pourriez étudier leurs propriétés en laboratoire.
Environ 90 de ces éléments chimiques ont été identifiés dans la nature. Car parmi les éléments avec un numéro de série inférieur à 92 (jusqu'à l'uranium), il n'y a pas de technétium (43) et de francium (87) dans la nature. Il n'y a pratiquement pas d'astate (85) Par contre, on trouve aussi bien du neptunium (93) que du plutonium (94) (éléments transuraniens instables) dans la nature là où se trouvent les minerais d'uranium. Tous les éléments suivant le plutonium Pu dans le système périodique de Mendeleïev sont totalement absents de la croûte terrestre, bien que certains d'entre eux se soient sans aucun doute formés dans l'espace lors des explosions de supernova. Mais ils ne vivent pas longtemps...
À ce jour, les scientifiques ont synthétisé 26 éléments transuraniens, en commençant par le neptunium (N = 93) et en terminant par l'élément avec le nombre N = 118 (le nombre de l'élément correspond au nombre de protons dans le noyau atomique et au nombre d'électrons autour du noyau atomique).
Les éléments chimiques transuraniens de 93 à 100 sont obtenus dans les réacteurs nucléaires, et le reste - à la suite de réactions nucléaires dans les accélérateurs de particules. La technologie pour obtenir des éléments transuraniens dans les accélérateurs est fondamentalement claire: ils accélèrent les noyaux appropriés chargés positivement du noyau d'éléments avec un champ électrique aux vitesses requises et les poussent contre une cible contenant d'autres éléments plus lourds - processus de fusion et de désintégration des noyaux atomiques de divers éléments ont lieu. Les produits de ces processus sont analysés et des conclusions sont tirées sur la formation de nouveaux éléments.
Des scientifiques allemands du Centre Helmholtz pour l'étude des ions lourds dans une série d'expériences en 2013-2014 avaient prévu d'obtenir le prochain 119e élément du tableau périodique, mais ont échoué. Ils ont tiré des noyaux de berkelium (N = 97) avec des noyaux de titane (N = 22), mais l'analyse des données expérimentales n'a pas confirmé la présence du nouvel élément.
À l'heure actuelle, l'existence de cent dix-huit éléments chimiques peut être considérée comme identifiée. Les rapports de la découverte du 119e - le premier élément de la 8e période - peuvent être considérés pour l'instant comme hypothétiques. Il y a eu des déclarations sur la synthèse de l'élément unbiquadium (124) et des preuves indirectes des éléments unbinilium (120) et unbigexia (126), mais ces résultats sont encore au stade de la confirmation.
Maintenant, enfin, tous les 118 éléments officiellement connus et prouvés à ce jour ont des noms généralement reconnus approuvés par l'IUPAC. Il n'y a pas si longtemps, l'élément le plus lourd avec un nom officiellement reconnu était le 116e élément, qui l'a reçu en mai 2012 - Livermore. Dans le même temps, le nom du 114e élément a été officiellement approuvé - flerovium.
Combien d'éléments chimiques pouvez-vous obtenir ? Théoriquement, la possibilité de synthétiser des éléments avec les numéros 121-126 est prédite. Ce sont les nombres de protons dans les noyaux des éléments. Le problème de la limite inférieure du tableau périodique reste l'un des plus importants de la chimie théorique moderne.
Chaque élément chimique possède plusieurs isotopes. Les isotopes sont des atomes dans le noyau desquels se trouvent le même nombre de protons, mais un nombre différent de neutrons. Le monde des noyaux atomiques des éléments chimiques est très diversifié. Environ 3500 noyaux sont maintenant connus, différant les uns des autres soit par le nombre de protons, soit par le nombre de neutrons, soit les deux. La plupart d'entre eux sont obtenus par des moyens artificiels. La question est très intéressante - combien d'isotopes un élément donné peut-il avoir ?
Il existe 264 noyaux atomiques connus qui sont stables, c'est-à-dire qui ne subissent aucune transformation spontanée rapide dans le temps. Se désintègre.
Le reste des carottes d'un montant de 3236 sont soumis à différents types désintégration radioactive : désintégration alpha (émission de particules alpha - les noyaux d'un atome d'hélium) ; la désintégration bêta (émission simultanée d'un électron et d'un antineutrino ou d'un positon et d'un neutrino, ainsi que l'absorption d'un électron avec l'émission d'un neutrino) ; désintégration gamma (émission de photons - ondes électromagnétiques de haute énergie).
Parmi les éléments chimiques connus du système périodique de Mendeleev, qui se trouvent sur Terre, seuls 75 ont des auteurs précisément et généralement reconnus de leur découverte - détection et identification. ce n'est que dans ces conditions - détection et identification - que le fait de la découverte d'un élément chimique est reconnu.
Des scientifiques de seulement neuf pays ont participé à la découverte réelle - l'isolement sous forme pure et l'étude des propriétés - d'éléments chimiques trouvés dans la nature : Suède (22 éléments), Angleterre (19 éléments), France (15 éléments), Allemagne ( 12 éléments). L'Autriche, le Danemark, la Russie, la Suisse et la Hongrie sont à l'origine de la découverte des 7 éléments restants.
Parfois ils désignent l'Espagne (platine) et la Finlande (yttrium - en 1794, dans un minéral suédois d'Ytterby, le chimiste finlandais Johan Gadolin découvrit un oxyde d'un élément inconnu). Mais le platine, en tant que métal noble, est connu sous sa forme native depuis l'Antiquité - sous sa forme pure, le platine a été obtenu à partir de minerais par le chimiste anglais W. Wollaston en 1803. Ce scientifique est mieux connu comme le découvreur du minéral wollastonite.
L'yttrium métallique a été obtenu pour la première fois en 1828 par le scientifique allemand Friedrich Wöhler.
Le détenteur du record parmi les "chasseurs" d'éléments chimiques peut être considéré comme le chimiste suédois K. Scheele - il a découvert et prouvé l'existence de 6 éléments chimiques : fluor, chlore, manganèse, molybdène, baryum, tungstène.
Aux réalisations dans les découvertes d'éléments chimiques de ce scientifique, on peut également ajouter le septième élément - l'oxygène, mais l'honneur de la découverte dont il partage officiellement avec le scientifique anglais J. Priestley.
La deuxième place dans la découverte de nouveaux éléments appartient à V. Ramzai -
Scientifique anglais ou, plus précisément, écossais : ils ont découvert l'argon, l'hélium, le krypton, le néon, le xénon. Soit dit en passant, la découverte de "l'hélium" est très curieuse. Il s'agit de la première découverte non « chimique » d'un élément chimique. Il est maintenant attribué à U. Ramzai, mais a été réalisé par d'autres scientifiques. Cela arrive souvent.
Le 18 août 1868, le scientifique français Pierre Jansen, avec plein éclipse solaire dans la ville indienne de Guntur, a d'abord exploré la chromosphère du Soleil. Il a réglé le spectroscope de manière à ce que le spectre de la couronne solaire puisse être observé non seulement pendant une éclipse, mais aussi les jours ordinaires. Il a identifié avec les lignes d'hydrogène - bleu, vert-bleu et rouge - une ligne jaune vif, qu'il a initialement prise pour la ligne de sodium. Janssen a écrit à ce sujet à l'Académie française des sciences.
Par la suite, il a été constaté que cette raie jaune vif du spectre solaire ne coïncide pas avec la raie du sodium et n'appartient à aucun des éléments chimiques précédemment connus.
27 ans après cette découverte initiale, l'hélium a été découvert sur Terre - en 1895, le chimiste écossais William Ramsay, examinant un échantillon de gaz obtenu à partir de la décomposition du minéral cleveite, a trouvé dans son spectre la même raie jaune vif trouvée plus tôt dans le spectre solaire . L'échantillon a été envoyé pour des recherches complémentaires au célèbre spectroscopiste anglais William Crookes, qui a confirmé que la raie jaune observée dans le spectre de l'échantillon coïncide avec la raie D3 de l'hélium.
Le 23 mars 1895, Ramsay envoya un message sur sa découverte de l'hélium sur Terre à la Royal Society de Londres, ainsi qu'à l'Académie française par l'intermédiaire de la célèbre chimiste Marceline Berthelot. c'est ainsi qu'est né le nom de cet élément chimique. Du nom grec du soleil - hélios. La première découverte faite par la méthode spectrale. Spectroscopie d'absorption.
Dans tous les cas, Ramsay avait des co-auteurs : V. Crooks (Angleterre) - hélium ; W. Rayleigh (Angleterre) - argon ; M. Travers (Angleterre) - krypton, néon, xénon.
4 éléments ont été trouvés :
I. Berzelius (Suède) - cérium, sélénium, silicium, thorium;
G. Devi (Angleterre) - potassium, calcium, sodium, magnésium;
P. Lecoq de Boisbaudran (France) - gallium, samarium, gadolinium, dysprosium.
La Russie rend compte de la découverte d'un seul des éléments naturels : le ruthénium (44). Le nom de cet élément vient du nom latin tardif de la Russie - Ruthénie. Cet élément a été découvert par le professeur de l'Université de Kazan Karl Klaus en 1844.
Karl-Ernst Karlovich Klaus était un chimiste russe, l'auteur de plusieurs ouvrages sur la chimie des métaux du groupe du platine et le découvreur de l'élément chimique ruthénium. Il est né le 11 (22) janvier 1796 - 12 (24) mars 1864) à Dorpat, l'ancienne ville russe de Yuryev (aujourd'hui Tartu), dans la famille de l'artiste. En 1837, il a soutenu sa thèse de maîtrise et a été nommé adjoint au département de chimie de l'Université de Kazan. Depuis 1839, il est devenu professeur de chimie à l'Université de Kazan, et depuis 1852 - professeur de pharmacie à l'Université de Dorpat. En 1861, il devint membre correspondant de l'Académie des sciences de Saint-Pétersbourg.
Le fait que la plupart des éléments chimiques connus dans la nature aient été découverts par des scientifiques de Suède, d'Angleterre, de France et d'Allemagne est tout à fait compréhensible - aux 18-19 siècles, lorsque ces éléments ont été découverts, ces pays avaient le plus haut niveau de développement de la chimie et la technologie chimique. ...
Une autre question intéressante est : les femmes scientifiques ont-elles découvert des éléments chimiques ?
Oui. Mais un peu. Il s'agit de Maria Skladovskaya-Curie, qui a découvert le polonium en 1898 avec son mari P. Curie (le nom a été donné en l'honneur de sa patrie de Pologne) et le radium, Lisa Meitner, qui a participé à la découverte du protactinium (1917), Ida Noddak (Takke), qui découvre en 1925, avec son futur mari V. Noddak, le rhénium, et Marguerite Perey, qui découvre la France en 1939 et devient la première femme élue à l'Académie française des sciences.
Dans le tableau périodique moderne, il y a plusieurs éléments, en plus du ruthénium, dont les noms sont associés à la Russie : samarium (63) - du nom de la samarskite minérale, découverte par l'ingénieur minier russe VM Samarsky dans les montagnes d'Ilmen, Mendeleevium ( 101); dubnium (105). L'histoire derrière le nom de cet élément est curieuse. Pour la première fois cet élément a été obtenu à l'accélérateur de Dubna en 1970 par le groupe de G.N. Flerov en bombardant des noyaux 243Am avec des ions 22Ne et indépendamment à Berkeley (USA) dans la réaction nucléaire 249Cf + 15N = 260Db + 4n.
Des chercheurs soviétiques ont proposé de nommer le nouvel élément Nielsborium (Ns), en l'honneur du grand scientifique danois Niels Bohr, les Américains - Ganium (Ha), en l'honneur d'Otto Hahn, l'un des auteurs de la découverte de la fission spontanée de l'uranium.
Un groupe de travail de l'IUPAC a conclu en 1993 que l'honneur de découvrir l'élément 105 devrait être partagé entre les équipes de Dubna et de Berkeley. La Commission IUPAC a proposé le nom Joliotium (Jl) en 1994, après Joliot-Curie. Avant cela, l'élément s'appelait officiellement le chiffre latin - unilpentium (Unp), c'est-à-dire simplement le 105e élément. Les symboles Ns, Na, Jl sont encore visibles dans les tableaux d'éléments publiés les années précédentes. Par exemple, à l'examen d'État unifié de chimie en 2013. Selon la décision finale de l'IUPAC en 1997, cet élément a été nommé "dubnium" - en l'honneur du centre russe de recherche dans le domaine de la physique nucléaire, la ville scientifique de Dubna.
À l'Institut commun de recherche nucléaire de Doubna, à différentes époques, des éléments chimiques superlourds portant les numéros de série 113-118 ont été synthétisés pour la première fois. L'élément 114 a été nommé "flerovium" - en l'honneur du Laboratoire des réactions nucléaires. GNFlyorov de l'Institut commun de recherche nucléaire, où cet élément a été synthétisé.
Au cours des 50 dernières années, le tableau périodique des D.I. Mendeleev a été reconstitué avec 17 nouveaux éléments (102-118), dont 9 ont été synthétisés au JINR, y compris au cours des 10 dernières années - 5 des éléments les plus lourds (superlourds), fermant tableau périodique…
Pour la première fois, le 114ème élément - avec un nombre "magique" de protons (les nombres magiques sont une série de nombres naturels pairs correspondant au nombre de nucléons dans un noyau atomique, auquel l'une de ses coquilles se remplit complètement : 2, 8, 20, 28, 50, 82 , 126 (le dernier chiffre concerne uniquement les neutrons) - a été obtenu par un groupe de physiciens dirigé par Yu.Ts. Oganesyan à l'Institut commun de recherche nucléaire (Dubna, Russie) avec la participation de scientifiques du Livermore National Laboratory (Livermore, USA ; collaboration Dubna-Livermore) en décembre 1998 par la synthèse d'isotopes de cet élément par réaction de fusion de noyaux de calcium avec des noyaux de plutonium. Le nom du 114ème élément a été approuvé en mai 30 2012 : "Flerovium" et la désignation symbolique de Fl. Ensuite, le 116e élément a été nommé - "livermorium" (Livermorium) - Lv (d'ailleurs, la durée de vie de cet élément est de 50 millisecondes).
Actuellement, la synthèse des éléments transuraniens est principalement réalisée dans quatre pays : les USA, la Russie, l'Allemagne et le Japon. En Russie, de nouveaux éléments sont obtenus au Joint Institute for Nuclear Research (JINR) à Dubna, aux USA - au Oak Ridge National Laboratory au Tennessee et au Lawrence National Laboratory à Livermore, en Allemagne - au Helmholtz Heavy Ion Research Center (alias l'Institut des ions lourds) à Darmstadt, au Japon - à l'Institut de recherche physique et chimique (RIKEN).
Pour la paternité de la création du 113e élément, il y a longtemps eu une lutte entre le Japon et le groupe de scientifiques russo-américains. Des scientifiques japonais dirigés par Kosuke Morita ont synthétisé l'élément 113 en septembre 2004 en accélérant et en entrant en collision le zinc-30 et le bismuth-83. Ils ont réussi à enregistrer trois chaînes de désintégration correspondant aux chaînes de production du 113e élément en 2004, 2005 et 2012.
Des scientifiques russes et américains ont annoncé la création du 113e élément lors de la synthèse du 115e élément à Doubna en février 2004 et ont proposé de l'appeler Becquerel. Par le nom physicien hors pair Antoine Henri Becquerel (P. Antoine Henri Becquerel ; 15 décembre 1852 - 25 août 1908) - physicien français, lauréat du prix Nobel de physique et l'un des découvreurs de la radioactivité.
Enfin, début 2016, les noms de quatre nouveaux éléments chimiques ont été officiellement ajoutés au tableau périodique. Les éléments portant les numéros atomiques 113, 115, 117 et 118 ont été vérifiés par l'Union internationale de chimie pure et appliquée (IUPAC).
L'honneur de découvrir les 115e, 117e et 118e éléments a été décerné à une équipe de scientifiques russes et américains du Joint Institute for Nuclear Research de Doubna, du Livermore National Laboratory en Californie et du Oak Ridge National Laboratory au Tennessee.
Jusqu'à récemment, ces éléments (113, 115, 117 et 118) ne portaient pas les noms les plus sonores d'Untrias (Uut), Ununpentiums (Uup), Ununseptides (Uus) et Ununoctias (Uuo), cependant, dans les cinq mois suivants, les découvreurs des éléments sauront leur donner de nouveaux noms définitifs.
Les scientifiques de l'Institut japonais des sciences naturelles (RIKEN) sont officiellement reconnus comme les découvreurs du 113e élément. En l'honneur de cela, il a été recommandé que l'élément s'appelle "Japon". Le droit de proposer des noms pour le reste des nouveaux éléments a été donné aux découvreurs, pour lesquels ils ont eu cinq mois, après quoi ils seraient formellement approuvés par le conseil de l'IUPAC.
Il est proposé que le 115e élément s'appelle « Moscovie » en l'honneur de la région de Moscou !
C'est fini! 8 juin 2016 Union internationale en chimie théorique et appliquée, il a annoncé les noms recommandés pour les éléments 113e, 115e, 117e et 118e du tableau périodique. Cela a été rapporté sur le site Web du syndicat.
L'un des nouveaux éléments superlourds du tableau périodique, le numéro 113, a été officiellement nommé « nichonium » et le symbole Nh. L'annonce correspondante a été faite par l'Institut japonais des sciences naturelles "Riken", dont les spécialistes avaient précédemment découvert cet élément.
Le mot "nikhoniy" est dérivé du nom local du pays - "Nihon".
L'Union internationale de chimie pure et appliquée a approuvé les noms du nouvel élément numéroté 113, 115, 117 et 118 - nichonium (Nh), muscovium (Mc), ténessine (Ts) et oganesson (Og).
Le 113e élément est nommé en l'honneur du Japon, le 115e - en l'honneur de la région de Moscou, 117e - du nom de l'État américain du Tennessee, 118e - en l'honneur du scientifique russe, académicien de l'Académie des sciences de Russie Yuri Oganesyan .
Sergei, apparemment tu es jeune et tu ne te sens pas comme faisant partie de notre pays. C'est compréhensible si vous êtes jeune, mais cela n'impose pas le respect si vous êtes un « citoyen de Moscou ».
1. "Comme lasse des politologues de canapé, des vantards et des arrivistes mal élevés qui sont partis vivre dans d'autres pays, et maintenant, à chaque occasion, essaient de verser des" compliments "à leurs anciens compatriotes."
Oui au diable avec eux, ils ne nous intéressent pas dans nos intérêts égoïstes - comment nous devrions vivre .. Bien qu'il soit dommage de perdre un tel. Ce sont des gens, au moins, qui n'ont pas peur de se déchaîner et de recommencer leur vie à partir de zéro et au bas de l'échelle sociale.
2. "Je ne comprends pas non plus l'agression des habitants de l'Ukraine. Et les habitants d'autres pays. Mais pourquoi se mettre en colère contre des gens ordinaires comme nos lecteurs ou les journalistes de notre portail ? Nous n'avons rien à voir avec tout cela Nous sommes assis ici, discutant calmement de sujets pseudo-scientifiques Et vous devriez vous mordre les dents sur les "Moscovites".
H'm... Les gens élevés dans le scoop, normalement élevés, s'assoient dans le sous-cortex : "Lève-toi, un pays immense..." quand l'ennemi entre sur nos terres. Gloire à Allah et au Bouddha que les Ukrainiens sont des individualistes et voulaient surtout aller dans leur pays. Alors ils chient sur Internet ou ils vont jurer sur les maudits Moscovites au lieu d'une guerre à part entière pour leur bout de terre... Et quelle option préférez-vous ?
3. "Ce qui se passe entre nos politiciens est une chose." Ne p .... soyez !! Les « petites guerres victorieuses » sont conçues pour provoquer une frénésie patriotique chez les petites gens ! 87% de soutien à Poutine est bien réel, au moins jusqu'à la chute du rouble ! Et ce sont précisément ces 87 % qui sont responsables de ce qui se passe avec les 13 % restants et avec nos voisins : « frères géorgiens », « frères ukrainiens ».
4. La chose la plus importante.
Même les Ukrainiens peuvent enfoncer un verrou dans la perte d'une partie du territoire, jusqu'à la violation de l'ego et des œufs. Et nous vivons ici. Et toi, Sergei, tu ne connais apparemment pas l'histoire de ta famille, ou elle s'est tenue à l'écart de ce qui se passait avec nous.
Et ma famille depuis de nombreuses générations a été soudée par le sang à cette terre. Seulement au 20ème siècle : 6 hommes ont combattu dans 3 guerres, deux ne sont pas revenus. 4 femmes et enfants sont morts de faim. Ils jouaient avec. 4 personnes ont péri dans les camps. Une arme atomique testée, est morte d'un cancer. Son fils est décédé à l'âge de 24 ans en raison des effets des radiations de son père. Deux scientifiques dans la famille, des dirigeants des industries chimiques et énergétiques, des médecins de la plus haute catégorie, un enseignant, un militaire qui a pris d'assaut le palais d'Amin.
Et à quoi ça sert tout ça ?? Les gens ont créé l'avenir, sans idiots, sans s'épargner eux-mêmes et la santé, ou ils ont survécu pour le bien des enfants. Et que voit-on ??? Oui, au diable avec elle, avec la pauvreté. Mais l'héritage des ancêtres est totalement détruit. Où et comment vivront nos enfants ? Kidalovo est devenu la norme au niveau de l'État. Dans le cadre des programmes fédéraux de financement "Eau Pure" il faut reverser jusqu'à 30% en cash !! Les jeunes sont stupides et analphabètes. Le concours le plus simple pour le comptage-écriture-physique-mathématiques est passé par 0,3-0,7% des diplômés des universités techniques ! De qui former des ingénieurs, des scientifiques appliqués ??
Combien de Nouvelles russes pour 2015, heureux pour nous ? Rejeté du prochain programme international ? Un autre "fi" d'autres pays ? Un nouvel effondrement du rouble ? Encore une réduction de la production et du marché dans son ensemble ?
Peu d'adultes savent combien d'éléments se trouvent dans le tableau périodique. De plus, vos connaissances peuvent être dépassées.
Le fait est que la table est toujours en formulaire ouvert, c'est-à-dire pas terminé, car tous ses composants ne sont pas connus.
Si un chimiste était interrogé sur la quantité éléments connusà la fin du XVIIe siècle, il dira avec assurance qu'ils sont au nombre de 21. Et même lorsque Mendeleïev développa la classification des éléments chimiques qui est utilisée à ce jour (1869-1871), seuls 63 d'entre eux ont été découverts.
Des tentatives de systématisation ont été faites à plusieurs reprises, mais il est très difficile de juger le tout par sa partie, et encore plus d'y chercher des motifs.
La difficulté résidait précisément dans le fait qu'à cette époque les scientifiques n'imaginaient pas qu'ils ne connaissaient que la moitié des maillons de la chaîne existante.
Dès que les scientifiques et les chercheurs ont essayé de construire la moitié du tableau qu'ils connaissaient. Cela a été fait non seulement par des chimistes, mais aussi par des musiciens à la recherche d'un système selon la loi des octaves.
Newlands a presque réussi, mais il s'est compromis avec un fond mystique qu'il a presque trouvé dans la chimie de l'harmonie musicale. Quelques années seulement après cela, la table que nous connaissons a été créée, dont le nombre de composants a progressivement augmenté jusqu'à nos jours.
Peut-être que le système dans les propriétés de ces 63 éléments a été révélé, selon la légende, par Mendeleev dans un rêve, mais il a lui-même dit que cela ne s'était pas produit soudainement, pas en un claquement de doigts. Pour trouver des motifs, il a réfléchi pendant près de 20 ans. De plus, il leur restait des espaces vides pour les maillons non découverts de cette longue chaîne.
Extension supplémentaire
À fin XIX siècle, le tableau était déjà rempli de 84 éléments (le développement de la spectroscopie a donné un nouvel élan aux découvertes), et au milieu du 20e siècle, 13 autres ont été ajoutés. Par conséquent, les écoliers en 1950 pouvaient dire avec confiance qu'il y a 97 composants dans Le tableau périodique.
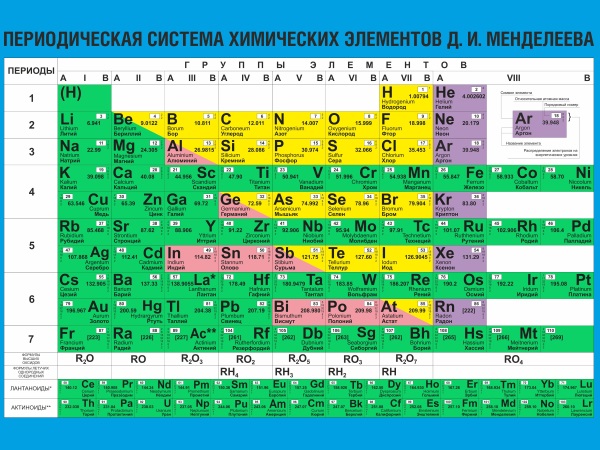
table de Mendeleïev.
Depuis, les éléments numérotés à partir de 98 ont progressivement ouvert et élargi le tableau après le début de l'utilisation de l'énergie atomique. Ainsi, en 2011, les 114e et 116e cellules étaient déjà remplies.
Début 2016, la table a été à nouveau réapprovisionnée - 4 nouveaux éléments y ont été ajoutés, bien qu'ils aient été ouverts beaucoup plus tôt.
Leurs numéros atomiques sont 113, 115, 117 et 118, et l'un des éléments chimiques d'origine japonaise (nom de travail ununtrium, ou abrégé en Uut). Cette découverte a finalement permis aux chimistes japonais, avec d'autres, d'entrer dans le tableau périodique, plaçant leur découverte dans la 113e cellule.
Le reste des éléments a été découvert par le groupe russo-américain :
- ununpentium, ou Uup (115) ;
- ununseptium, ou Uus (117) ;
- ununoctium, ou Uuo (118).
Ce sont des noms temporaires, et dans la seconde moitié de 2016, leurs vrais noms et abréviations à 2 lettres apparaîtront dans le tableau. Le droit de choisir les noms appartient aux découvreurs. On ignore encore où ils s'arrêteront.
Les noms peuvent être liés à la mythologie, à l'astronomie, à la géographie, ou ils peuvent être des termes de chimie, ou peut-être des noms de scientifiques.
Combien y en a-t-il au total ?
Même si vous savez exactement combien d'éléments se trouvent dans le tableau de Mendeleïev, vous pouvez répondre de deux manières, et les deux réponses seront correctes.
Le fait est que cette table a deux versions. L'un contient 118 composants et le second 126.
La différence entre eux est que dans la première version, les composants sont déjà ouverts et officiellement acceptés par la communauté scientifique, et dans la seconde, des composants hypothétiques sont également inscrits, c'est-à-dire qu'ils n'existent que sur papier et dans l'esprit des scientifiques. Ils peuvent être reçus demain, voire dans 100 ans.
Mais dans la version à 118 éléments, tous les composants existent réellement. Parmi ceux-ci, 94 se trouvent dans la nature, le reste est obtenu en laboratoire. Néanmoins, la deuxième option a aussi le droit d'exister, car la nature aime l'ordre.
Si une régularité montre que les éléments chimiques existants devraient avoir une continuation, alors tôt ou tard elle apparaîtra grâce à de nouvelles technologies encore inconnues.
