Tableau périodique du tableau de Mendeleev. Halogènes et gaz rares.
Instructions
Le tableau périodique est une "maison" à plusieurs étages dans laquelle se trouvent un grand nombre d'appartements. Chaque « locataire » ou élément chimique vit dans son propre appartement sous un certain nombre, qui est constant. De plus, l'élément a un "nom de famille" ou un nom, tel que l'oxygène, le bore ou l'azote. En plus de ces données, chaque « appartement » ou cellule contient des informations telles que la masse atomique relative, qui peut être précise ou arrondie.
Effets perturbateurs de la relativité
Si des éléments supplémentaires étaient synthétisés, ils seraient dans la nouvelle série du système. Au nombre de neuf, ils offrent de l'espace pour deux électrons supplémentaires, comme auparavant - donc en général la période sera prolongée d'autant, et système périodique s'étend à 50 colonnes ; Cependant, les chimistes ont déjà développé des vues plus compactes pour une table aussi large. 
Le tableau périodique complet, dont les lignes sont complètement remplies, peut apparaître comme l'accomplissement final du rêve de Mendeleev. Et si tel était le cas, il n'y aurait aucun trait particulier d'Albert Einstein et de ses théorie spéciale relativité.
Comme dans toute maison, il y a ici des « entrées », à savoir des groupes. De plus, dans les groupes, les éléments sont situés à gauche et à droite, formant des sous-groupes. Selon le côté où il y en a le plus, ce sous-groupe est appelé le principal. L'autre sous-groupe, respectivement, sera secondaire. Il y a aussi des « étages » ou des périodes dans le tableau. De plus, les périodes peuvent être à la fois grandes (composées de deux lignes) et petites (n'avoir qu'une seule ligne).
Au fur et à mesure que le nombre d'éléments augmente, le proton positif dans le noyau augmente sa valeur positive. charge électrique... En même temps, son attraction électrostatique se développe sur des électrons chargés négativement. Par conséquent, ils sont considérablement accélérés à mesure qu'ils s'approchent du noyau. Cela conduit au fait que les électrons dans les orbitales internes à des ordres élevés approchent si rapidement de la vitesse de la lumière. En conséquence, les effets de ceci sont de plus en plus appliqués. Par exemple, la masse des électrons augmente avec le temps.
Cela rétrécit l'orbite, en particulier l'intérieur, mais moins l'extérieur, et la stabilise en même temps. Tout cela s'appelle l'effet relativiste direct. Cependant, la théorie de la relativité produit également des effets indirects qui les contrecarrent. À mesure que les électrons internes s'approchent du noyau, ils filtrent plus fortement leur charge. Cela réduit l'attraction électrostatique des électrons externes, entraînant l'expansion des orbitales des couches supérieures.
Selon le tableau, vous pouvez montrer la structure de l'atome d'un élément, dont chacun a un noyau chargé positivement, composé de protons et de neutrons, ainsi que d'électrons chargés négativement qui tournent autour de lui. Le nombre de protons et d'électrons est numériquement le même et est déterminé dans le tableau par le nombre ordinal de l'élément. Par exemple, l'élément chimique soufre a le numéro 16, il aura donc 16 protons et 16 électrons.
Tout cela se ressent même en partie dans la vie de tous les jours. Ainsi, les effets relativistes font du mercure le seul métal liquide. Ils donnent également à l'or sa couleur jaunâtre et l'argent juste au-dessus dans le tableau périodique apparaît en bleu et blanc. Si un photon avec la bonne longueur d'onde frappe un atome de métal de transition, il est absorbé. Dans le cas de l'argent, l'écart énergétique entre les deux orbitales est suffisamment grand pour que cette transition nécessite un photon de la région ultraviolette du spectre.
Par conséquent, la lumière visible à économie d'énergie est simplement réfléchie, c'est pourquoi le métal agit comme un miroir idéal pour l'œil humain. Par conséquent, les photons du domaine spectral bleu suffisent à soulever un électron. D'un autre côté, la lumière de toutes les autres couleurs n'est toujours pas assez énergétique. Donc, il rebondit toujours, nous voyons donc une lumière blanche moins bleue, ce qui lui donne cette couleur jaune doré distinctive. Jusqu'au numéro 118, tous les éléments sont désormais connus. Ainsi, le tableau périodique est complet tel quel.
Pour déterminer le nombre de neutrons (particules neutres également situées dans le noyau), soustrayez son numéro de série de la masse atomique relative d'un élément. Par exemple, le fer a une masse atomique relative égale à 56 et un numéro de série 26. Par conséquent, 56 - 26 = 30 protons pour le fer.
Les électrons sont allumés distance différente du noyau, formant des niveaux électroniques. Pour déterminer le nombre de niveaux électroniques (ou énergétiques), il faut regarder le numéro de la période dans laquelle se trouve l'élément. Par exemple, l'aluminium est en période 3, il aura donc 3 niveaux.
Si des éléments supplémentaires étaient ajoutés, une nouvelle série devrait être créée pour eux. Pekka Pykkyo de l'Université d'Helsinki et d'autres ont prédit d'autres effets relativistes dans l'or, notamment le fait qu'il pourrait se combiner avec d'autres atomes de manière surprenante. Tout aussi exotique est une molécule sphérique dans laquelle un atome de tungstène est entouré de douze atomes d'or. Ce composé a la même structure que le célèbre fullerène de football, constitué de 60 atomes de carbone, et se forme spontanément lorsque le tungstène et l'or s'évaporent dans une atmosphère d'hélium, gaz protecteur.
Par le numéro de groupe (mais uniquement pour le sous-groupe principal), vous pouvez déterminer la valence la plus élevée. Par exemple, les éléments du premier groupe du sous-groupe principal (lithium, sodium, potassium, etc.) ont une valence de 1. Ainsi, les éléments du deuxième groupe (béryllium, magnésium, calcium, etc.) auront une valence de 2.
Vous pouvez également analyser les propriétés des éléments de la table. De gauche à droite, les propriétés métalliques sont affaiblies et les propriétés non métalliques sont améliorées. Cela se voit bien dans l'exemple de la période 2 : elle commence par un métal alcalin sodium, puis un métal alcalino-terreux magnésium, après elle un élément amphotère aluminium, puis des non-métaux silicium, phosphore, soufre, et la période se termine par des substances gazeuses - chlore et argon. Dans la période suivante, une relation similaire est observée.
Les calculs de mécanique quantique relativiste se sont également avérés inestimables pour répondre à la question de savoir comment de minuscules morceaux d'atomes d'or agissent comme catalyseurs de sorte qu'ils décomposent les substances toxiques dans les gaz d'échappement des voitures, bien que le métal précieux ne réagisse généralement pas très bien.
Malgré ces effets relativistes, les écarts par rapport à la nature attendue de cet élément sont encore limités. Même les actinides, avec leurs nombres ordinaux beaucoup plus élevés, ont, en général, des propriétés correspondant à leur position dans le tableau périodique. Vraiment mauvais, mais aussi intéressant - les surprises ne sont apparues que dans les éléments lourds nouvellement créés. Leur chimie, comme l'ont montré les tests précédents, indique de sérieuses fissures dans le magazine.
De haut en bas, un motif est également observé - les propriétés métalliques augmentent et les propriétés non métalliques s'affaiblissent. C'est-à-dire que, par exemple, le césium est beaucoup plus actif que le sodium.
La découverte de la loi périodique et la création d'un système ordonné d'éléments chimiques par D.I. Mendeleev est devenu l'apogée du développement de la chimie au 19ème siècle. Le scientifique a généralisé et systématisé une vaste quantité de connaissances sur les propriétés des éléments.
Les physiciens peuvent tirer sur des noyaux lourds dans des accélérateurs de particules afin qu'ils fusionnent pour former des éléments « super-élévateurs » - l'un d'eux avec des nombres ordinaux. Les deux premiers étaient Rutherford et Dubnium. De même, à Dubnia, du cinquième sous-groupe, il existe des preuves qu'il se comporte comme un protactinium actinoïde encore plus actif.
Cependant, selon la loi de l'époque, les deux devaient être similaires dans leurs propriétés chimiques avec les éléments directement au-dessus d'eux, c'est-à-dire l'hafnium et le tantale. Dans ces conditions, il est impossible d'étudier leurs propriétés chimiques en utilisant la chimie « humide » traditionnelle - les collecter sous forme dissoute avec des partenaires de réaction potentiels et voir ce qui se passe.
Instructions
Au 19ème siècle, on n'avait aucune idée de la structure de l'atome. D.I. Mendeleïev n'était qu'une généralisation de faits expérimentaux, mais leur signification physique resta longtemps incompréhensible. Lorsque les premières données sur la structure du noyau et la répartition des électrons dans les atomes sont apparues, cela a permis d'appréhender la loi périodique et le système des éléments d'une manière nouvelle. D.I. Mendeleev permet de tracer visuellement la périodicité des propriétés des éléments trouvés dans la nature.
Cependant, les chercheurs ont développé des méthodes sophistiquées pour étudier la chimie de ces éléments sur des atomes individuels. Dans de telles expériences, Seaborgium et Borium ont de nouveau montré des propriétés chimiques qui correspondaient à leur position dans le tableau périodique. Pour clarifier cela, les équipes de recherche ont également synthétisé certains des isotopes instables lourds des deux éléments comparatifs. La raison en était qu'ils pouvaient être produits et recherchés de la même manière que Copernic. En conséquence, les résultats expérimentaux étaient meilleurs par rapport aux propriétés macroscopiques des isotopes naturels les plus fréquents.
Chaque élément du tableau se voit attribuer un numéro de série spécifique (H - 1, Li - 2, Be - 3, etc.). Ce nombre correspond à la charge du noyau (le nombre de protons dans le noyau) et au nombre d'électrons en orbite autour du noyau. Le nombre de protons est donc égal au nombre d'électrons, ce qui suggère que dans des conditions normales, l'atome est électriquement neutre.
La division en sept périodes se produit en fonction du nombre de niveaux d'énergie de l'atome. Les atomes de la première période ont une couche électronique à un seul niveau, la seconde à deux niveaux, la troisième à trois niveaux, etc. Lorsqu'un nouveau niveau d'énergie est rempli, une nouvelle période commence.
Dans les expériences, des atomes fraîchement cuits ont été déposés sur une surface refroidie à très basse température et recouverte en partie d'or, en partie de glace. Si le copernicium était comme le mercure, il devrait former un amalgame avec l'or. Ce sera plutôt du radon, mais il tombera plutôt sur la glace. Aussi simple que puisse paraître l'expérience, elle n'a donné aucun résultat clair : les laboratoires individuels ont reçu des résultats différents, la question reste donc ouverte.
De plus, selon ces études, il est encore plus volatil que le mercure et est même présent sous forme de gaz à température ambiante. Si le tableau périodique continue de croître, de nouveaux ajouts sont susceptibles de fournir des informations plus précises sur sa validité dans le cas des superéléments. Cependant, la question n'a aucune signification pratique dans un avenir prévisible. Si le pouvoir de prédiction disparaît avec les nombres d'ordre les plus élevés, l'utilité de la table restante n'est pas diminuée. Et le chimiste typique ne devrait jamais avoir à traiter avec des éléments superlourds.
Les premiers éléments de toute période sont caractérisés par des atomes ayant un électron au niveau externe - ce sont les atomes de métaux alcalins. Les périodes se terminent par des atomes de gaz rares, qui ont un niveau d'énergie externe complètement rempli d'électrons : dans la première période, les gaz inertes ont 2 électrons, dans la suivante - 8. C'est à cause de la structure similaire des couches d'électrons que les groupes d'éléments ont des propriétés physico-chimiques similaires.
Étant donné que les représentants actuels ne peuvent être produits qu'en quantités infimes et se désintègrent généralement en quelques secondes, ils ne peuvent rien y faire. Cependant, à partir du modèle de coquille du noyau atomique, les éléments avec certains nombres « magiques » de protons et de neutrons correspondant à des coquilles remplies devraient être particulièrement stables. Il est exceptionnellement grand à 2,7 secondes. Cela conduit à une question plus générale lorsque la liste des éléments se termine enfin. De l'avis unanime de l'expert, aucun noyau atomique ne peut se former, même pendant un instant fugace, si le nombre de protons est trop important.
D.I. Mendeleev, il existe 8 sous-groupes principaux. Ce nombre est dû au nombre maximum possible d'électrons au niveau de l'énergie.
Au bas du tableau périodique, les lanthanides et les actinides sont distingués en séries indépendantes.
En utilisant le tableau D.I. Mendeleïev, on peut observer la périodicité des propriétés suivantes des éléments : le rayon de l'atome, le volume de l'atome ; potentiel d'ionisation; les forces d'affinité avec l'électron ; électronégativité de l'atome; état d'oxydation; propriétés physiques des composés potentiels.
Mais où est exactement la frontière, les avis divergent. Dans les calculs avec un noyau ponctuel, il semble se trouver avec l'élément 137. D'autres théoriciens estiment un volume réel de noyau de 172 ou 173 pour l'élément le plus complexe. Cela laisse beaucoup de place à de nouvelles découvertes et peut-être à des noyaux relativement stables dont la chimie peut être étudiée. Rien de plus, la position dans le tableau périodique ne jouera probablement plus aucun rôle.
Sur l'histoire du tableau périodique des éléments Prof. Et sans avertissement, "l'or élémentaire" signifie aussi "l'atome d'or" qui ne peut pas avoir de point de fusion, ou ne peut pas diriger le courant, qui est incolore au sens où nous entendons la couleur, mais produit plutôt de la couleur uniquement lorsque le nombre d'atomes est très grand. formé dans des particules d'une substance ou d'une partie d'un matériau. Ensuite, l'or peut être rouge ou vert ou jaune lorsqu'il est vu pendant la journée. La prise en compte des substances élémentaires a été au premier plan du siècle, depuis l'élaboration du tableau périodique des éléments.
Par exemple, les rayons des atomes, vus le long de la période, diminuent de gauche à droite ; croître de haut en bas lorsqu'on les regarde le long du groupe.
Une périodicité clairement traçable de la disposition des éléments dans le tableau de D.I. Mendeleev s'explique rationnellement par la nature cohérente du remplissage des niveaux d'énergie avec des électrons.
Sources:
Toute substance élémentaire, en principe, est au moins constituée des mêmes atomes. Ainsi, chaque atome de billard est un atome étranger. L'Anglais Robert Boyle peut être considéré comme le fondateur de la chimie moderne : il fut le premier à classer les acides parmi les substances qui transforment les colorants végétaux bleus en colorants rouges et dissolvent le marbre. Les motifs peuvent inverser ce processus. Il a également fait valoir de manière convaincante qu'il n'y avait pas quatre éléments - l'eau, la terre, le feu, l'air - mais bien plus d'éléments expliquant la variété des substances, et qu'il est nécessaire de nommer ces substances unifiées qui ne doivent en aucun cas être transférées dans deux autres substances.
- table de Mendeleïev
Droit périodique, qui est la base de la chimie moderne et explique les modèles de changements dans les propriétés des éléments chimiques, a été découvert par D.I. Mendeleïev en 1869. La signification physique de cette loi est révélée lors de l'étude de la structure complexe de l'atome.

L'eau est connue pour produire de l'hydrogène et de l'oxygène, à partir de chaux calcinée et de dioxyde de carbone. Mais le soufre ne reste toujours que du soufre, tant qu'il chauffe ou draine, ils essaient aussi de l'électrolyser. Le sujet de ce congrès était la nomenclature des composés chimiques et leur présentation formelle, ainsi que la question des poids atomiques et moléculaires des composés chimiques. Mendeleev et Meyer ont tous deux développé leurs systèmes par motivation didactique : pour donner un aperçu de l'abondance de toutes les substances qui ont déjà été identifiées et qui doivent encore être identifiées.
Au 19ème siècle, on croyait que la masse atomique était la principale caractéristique d'un élément, par conséquent, elle était utilisée pour classer les substances. Maintenant, les atomes sont déterminés et identifiés par la charge de leur noyau (le nombre de protons et le nombre ordinal dans le tableau périodique). Cependant, la masse atomique des éléments, à quelques exceptions près (par exemple, la masse atomique du potassium est inférieure à la masse atomique de l'argon), augmente proportionnellement à leur charge nucléaire.
Dans la question encore plus profonde de savoir s'il est possible de tracer des substances élémentaires jusqu'à une matière primordiale, "proto-haute", Mendeleev et Meyer différaient. Meyer, une hypothèse développée par l'Anglais William Pruth, dépendait du fait que toute la matière était finalement composée d'hydrogène hautement condensé, tandis que Mendeleev la contredisait sur la base des écarts dans les masses molaires des substances atomiques. Mendeleev et Meyer à cette époque ne pouvaient pas savoir que dans la micro-gamme des protons, des neutrons et des électrons, la loi de conservation de la masse ne peut plus être appliquée en raison de l'équivalence en poids de la masse et de l'énergie.
Avec une augmentation de la masse atomique, un changement périodique des propriétés des éléments et de leurs composés est observé. Ce sont la métallicité et la non-métallicité des atomes, le rayon et le volume atomique, le potentiel d'ionisation, l'affinité électronique, l'électronégativité, les états d'oxydation, les propriétés physiques des composés (points d'ébullition, points de fusion, densité), leur basicité, amphotéricité ou acidité.
Combien y a-t-il d'éléments dans le tableau périodique moderne
Le tableau périodique exprime graphiquement la loi périodique découverte par lui. Le tableau périodique moderne contient 112 éléments chimiques (ces derniers sont Meitnerium, Darmstadtium, Roentgenium et Copernicus). Selon les dernières données, les 8 éléments suivants (jusqu'à 120 inclus) ont été découverts, mais tous n'ont pas reçu leurs noms, et ces éléments sont encore peu nombreux dans lesquels des éditions imprimées sont présentes.
Chaque élément occupe une certaine cellule du tableau périodique et possède son propre numéro de série correspondant à la charge du noyau de son atome.
Comment le système périodique est construit
La structure du système périodique est représentée par sept périodes, dix lignes et huit groupes. Chaque période commence par un métal alcalin et se termine par un gaz noble. Les exceptions sont la première période, qui commence par l'hydrogène, et la septième période inachevée.
Les périodes sont divisées en petites et grandes. Les petites périodes (première, deuxième, troisième) se composent d'une rangée horizontale, les grandes (quatrième, cinquième, sixième) - de deux rangées horizontales. Les rangées supérieures dans les grandes périodes sont appelées paires, les inférieures - impaires.
Dans la sixième période du tableau, après le lanthane (numéro de série 57), il y a 14 éléments similaires en propriétés au lanthane - les lanthanides. Ils sont placés dans la partie inférieure de la table dans une ligne séparée. Il en va de même pour les actinides situés après l'actinium (numéro 89) et reprenant à bien des égards ses propriétés.
Même les rangées de grandes périodes (4, 6, 8, 10) ne sont remplies que de métaux.
Les éléments des groupes présentent la même valence la plus élevée dans les oxydes et autres composés, et cette valence correspond au numéro de groupe. Les sous-groupes principaux contiennent des éléments de petites et grandes périodes, les secondaires - uniquement les grandes. De haut en bas, les propriétés métalliques augmentent, les propriétés non métalliques s'affaiblissent. Tous les atomes des sous-groupes latéraux sont des métaux.
Lors du chauffage de toute modification de cet élément chimique au-dessus de 220°C et du refroidissement ultérieur, du sélénium vitreux se forme, il est fragile et a un éclat vitreux.
Le sélénium gris thermiquement hexagonal le plus stable, dont le réseau est constitué de chaînes d'atomes en spirale parallèles les unes aux autres. Il est obtenu en chauffant d'autres formes de sélénium jusqu'à fusion et refroidissement lent à 180-210°C. Les atomes à l'intérieur des chaînes de sélénium hexagonal sont liés de manière covalente.
Le sélénium est stable dans l'air, il n'est pas affecté par : l'oxygène, l'eau, les acides sulfurique et chlorhydrique dilués, mais il se dissout bien dans l'acide nitrique. Le sélénium interagit avec les métaux pour former des séléniures. De nombreux composés complexes du sélénium sont connus, tous sont toxiques.
Le sélénium est obtenu à partir de vieux papiers ou de la production d'acide sulfurique, par la méthode de raffinage électrolytique du cuivre. Dans les boues, cet élément est présent avec les métaux lourds et nobles, le soufre et le tellure. Pour l'extraire, les boues sont filtrées, puis chauffées à l'acide sulfurique concentré ou soumises à une torréfaction oxydante à une température de 700°C.

Instructions
Du latin "calcium" est traduit par "chaux" ou "pierre tendre", et il doit sa découverte à l'Anglais Humphrey Davy, qui en 1808 a pu isoler le calcium par la méthode électrolytique. Le scientifique a ensuite pris un mélange de chaux éteinte humide, "aromatisée" avec de l'oxyde de mercure, et l'a soumis à un processus d'électrolyse sur une plaque de platine, qui apparaît dans l'expérience comme une anode. La cathode était un fil que le chimiste plongeait dans du mercure liquide. Il est également intéressant de noter que des composés calciques tels que le calcaire, le marbre et le gypse, ainsi que la chaux, étaient connus de l'humanité depuis de nombreux siècles avant l'expérience de Davy, au cours de laquelle les scientifiques pensaient que certains d'entre eux étaient des corps simples et indépendants. Ce n'est qu'en 1789 que le Français Lavoisier publie un ouvrage dans lequel il suggère que la chaux, la silice, la barytine et l'alumine sont des substances complexes.
Le calcium a un degré élevé d'activité chimique, grâce à quoi il ne se présente pratiquement pas sous sa forme pure dans la nature. Mais les scientifiques estiment que cet élément représente environ 3,38 % de la masse totale de l'ensemble de la croûte terrestre, faisant du calcium le cinquième plus abondant après l'oxygène, le silicium, l'aluminium et le fer. Il y a cet élément dans l'eau de mer - environ 400 mg par litre. Le calcium entre également dans la composition des silicates de diverses roches (par exemple, granit et gneiss). Il est abondant dans le feldspath, la craie et les calcaires, constitués de calcite minérale de formule CaCO3. La forme cristalline du calcium est le marbre. Au total, par la migration de cet élément dans la croûte terrestre, il forme 385 minéraux.
Les propriétés physiques du calcium incluent sa capacité à présenter de précieuses capacités semi-conductrices, bien qu'il ne devienne pas un semi-conducteur et un métal au sens traditionnel du terme. Change cette situation avec une augmentation progressive de la pression, lorsque le calcium est doté d'un état métallique et de la capacité de manifester des propriétés supraconductrices. Le calcium interagit facilement avec l'oxygène, l'humidité de l'air et le dioxyde de carbone, grâce à quoi cet élément chimique est stocké dans des bocaux hermétiquement fermés dans les laboratoires pour le travail.
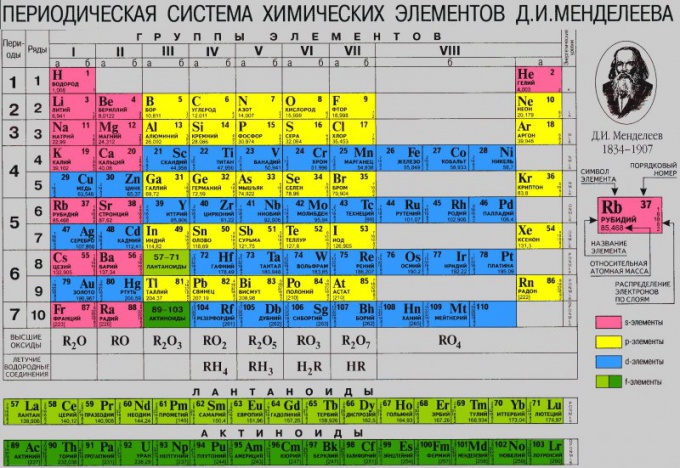
Histoire du tableau périodique
Au milieu du XIXe siècle, les scientifiques ont réussi à découvrir soixante-trois éléments chimiques, mais ils n'ont pas pu en construire une chaîne logique cohérente. Les éléments devaient être placés dans l'ordre de masse atomique croissante et divisés en groupes selon la similitude des propriétés chimiques.
Pour la première fois, le musicien et chimiste John Alexander Newland a proposé sa théorie, similaire à la future théorie de Mendeleev, mais la communauté scientifique a ignoré sa réalisation. La proposition de Newland n'a pas été prise au sérieux en raison de sa quête d'harmonie et d'un lien entre la musique et la chimie.
Dmitry Mendeleev a publié pour la première fois son tableau périodique en 1869 sur les pages du journal de la Société chimique russe. Le scientifique a également envoyé des avis de sa découverte à tous les plus grands chimistes du monde, après quoi il a amélioré et affiné à plusieurs reprises la table jusqu'à ce qu'elle devienne ce qu'elle est connue aujourd'hui. L'essence de la découverte de Dmitry Mendeleev était un changement périodique, plutôt que monotone, des propriétés chimiques des éléments avec une augmentation de la masse atomique. L'unification définitive de la théorie dans la loi périodique a eu lieu en 1871.
Légendes sur Mendeleïev
La légende la plus répandue est la découverte de la table par Mendeleev dans un rêve. Le scientifique lui-même a ridiculisé à plusieurs reprises ce mythe, affirmant qu'il avait inventé la table au fil des ans. Selon une autre légende, Dmitry Mendeleev a inventé la vodka - elle est apparue après que des scientifiques aient défendu leur thèse "Discours sur la combinaison de l'alcool et de l'eau".
Mendeleev est encore considéré par beaucoup comme le découvreur de la vodka, qui aimait lui-même créer sous une solution hydroalcoolique. Les contemporains du scientifique se moquaient souvent du laboratoire de Mendeleev, qu'il équipait au creux d'un chêne géant.
Selon les rumeurs, une autre raison des blagues était la passion de Dmitry Mendeleev pour le tissage de valises, dans laquelle le scientifique était engagé alors qu'il vivait à Simferopol. Plus tard, il a fabriqué de ses propres mains des conteneurs en carton pour les besoins de son laboratoire, pour lequel il a été sarcastiquement appelé le maître des affaires des valises.
La table de Mendeleev, en plus de l'ordre des éléments chimiques dans système unifié, a permis de prédire la découverte de nombreux éléments nouveaux. Cependant, dans le même temps, les scientifiques ont reconnu certaines d'entre elles comme inexistantes, car incompatibles avec le concept de loi périodique. L'histoire la plus célèbre à cette époque était la découverte de nouveaux éléments tels que le coronium et le nébulium.
Pour plus de commodité, il est préférable d'utiliser la version colorée de la table.
Tableau périodique - un ensemble ordonné d'éléments chimiques, leur classification naturelle, qui est une expression graphique (tabulaire) de la loi périodique des éléments chimiques. Sa structure, à bien des égards similaire à la structure moderne, a été développée par DI Mendeleev sur la base de la loi périodique de 1869-1871.
Le prototype du système périodique était "l'expérience d'un système d'éléments basé sur leur poids atomique et leur similarité chimique", compilé par D.I. et les périodes des éléments. En conséquence, la structure du système périodique a acquis des contours largement modernes.
Le concept de la place d'un élément dans le système, déterminé par les nombres du groupe et de la période, est devenu important pour son évolution. Sur la base de ce concept, Mendeleev est arrivé à la conclusion qu'il est nécessaire de modifier les masses atomiques de certains éléments : l'uranium, l'indium, le cérium et ses satellites. C'était le premier utilisation pratique le système périodique. Mendeleev a également été le premier à prédire l'existence et les propriétés de plusieurs éléments inconnus. Le scientifique a décrit en détail les propriétés les plus importantes de l'ékaaluminium (futur gallium), de l'ékabor (scandium) et de l'ékasilicium (germanium). De plus, il a prédit l'existence d'analogues du manganèse (futurs technétium et rhénium), du tellure (polonium), de l'iode (astatine), du césium (france), du baryum (radium), du tantale (protactinium). Les prédictions du scientifique concernant ces éléments étaient de nature générale, puisque ces éléments étaient situés dans des zones peu étudiées du système périodique.
Les premières versions du tableau périodique n'étaient dans une large mesure qu'une généralisation empirique. Après tout, la signification physique de la loi périodique n'était pas claire, il n'y avait aucune explication des raisons du changement périodique des propriétés des éléments en fonction de l'augmentation des masses atomiques. À cet égard, de nombreux problèmes restaient sans solution. Y a-t-il des limites du tableau périodique ? Est-il possible de déterminer le nombre exact d'articles existants ? La structure de la sixième période est restée floue - quelle est la quantité exacte d'éléments de terres rares ? On ne savait pas s'il y avait encore des éléments entre l'hydrogène et le lithium, quelle est la structure de la première période. Par conséquent, jusqu'à la justification physique de la loi périodique et le développement de la théorie du système périodique, de sérieuses difficultés ont surgi plus d'une fois avant elle. La découverte en 1894-1898 était inattendue. cinq gaz inertes, qui semblaient n'avoir aucune place dans le tableau périodique. Cette difficulté a été éliminée grâce à l'idée d'inclure un groupe zéro indépendant dans la structure du tableau périodique. La découverte massive des radioéléments au tournant des XIXe et XXe siècles. (en 1910 leur nombre était d'environ 40) a conduit à une nette contradiction entre la nécessité de leur placement dans le système périodique et sa structure établie. Il n'y avait que 7 postes vacants pour eux dans les sixième et septième périodes. Ce problème a été résolu grâce à l'établissement de règles de décalage et à la découverte d'isotopes.
L'une des principales raisons de l'impossibilité d'expliquer la signification physique de la loi périodique et la structure du système périodique était qu'on ne savait pas comment l'atome est structuré (voir Atome). L'étape la plus importante dans le développement du système périodique a été la création du modèle atomique par E. Rutherford (1911). Sur sa base, le scientifique néerlandais A. Van den Bruck (1913) a suggéré que le nombre ordinal d'un élément du tableau périodique est numériquement égal à la charge du noyau de son atome (Z). Ceci a été confirmé expérimentalement par le scientifique anglais G. Moseley (1913). La loi périodique a reçu une justification physique: la périodicité des changements dans les propriétés des éléments a commencé à être considérée en fonction de Z - la charge du noyau d'un atome d'un élément, et non de la masse atomique (voir. La loi périodique de éléments chimiques).
En conséquence, la structure du tableau périodique a été considérablement renforcée. La borne inférieure du système a été déterminée. C'est l'hydrogène - un élément avec un minimum de Z = 1. Il est devenu possible d'estimer avec précision le nombre d'éléments entre l'hydrogène et l'uranium. Ont été identifiés des "lacunes" dans le tableau périodique, correspondant à des éléments inconnus avec Z = 43, 61, 72, 75, 85, 87. Cependant, les questions sur la quantité exacte d'éléments de terres rares sont restées floues et, surtout, les raisons de la périodicité des changements dans les propriétés des éléments n'a pas été révélée en fonction de Z.
Sur la base de la structure existante du système périodique et des résultats de l'étude des spectres atomiques, le scientifique danois N. Bohr en 1918-1921. développé des idées sur la séquence de construction des couches électroniques et des sous-couches dans les atomes. Le scientifique est arrivé à la conclusion que des types similaires de configurations électroniques des enveloppes externes des atomes se répètent périodiquement. Ainsi, il a été montré que la périodicité des changements dans les propriétés des éléments chimiques s'explique par l'existence d'une périodicité dans la construction des couches électroniques et des sous-couches d'atomes.
Le tableau périodique couvre plus de 100 éléments. Parmi ceux-ci, tous les éléments transuraniens (Z = 93-110), ainsi que les éléments avec Z = 43 (technétium), 61 (prométhium), 85 (astatine), 87 (francium) ont été obtenus artificiellement. Au cours de toute l'histoire de l'existence du système périodique, un très grand nombre (> 500) de variantes de son image graphique, principalement sous forme de tableaux, ainsi que sous forme de formes géométriques diverses (spatiales et planes), de courbes analytiques (spirales, etc.), etc. Les plus répandues sont les formes courte, semi-longue, longue et échelle de tableaux. Actuellement, la forme courte est préférée.
Le principe fondamental de la construction du système périodique est sa division en groupes et périodes. Le concept mendeleïev de la série d'éléments n'est pas utilisé aujourd'hui, car il est dépourvu de sens physique. Les groupes, à leur tour, sont subdivisés en sous-groupes principaux (a) et secondaires (b). Chaque sous-groupe contient des éléments - des analogues chimiques. Les éléments des sous-groupes a et b de la plupart des groupes présentent également une certaine similitude entre eux, principalement dans les états d'oxydation supérieurs, qui, en règle générale, sont égaux au numéro de groupe. Une période est un ensemble d'éléments qui commence par un métal alcalin et se termine par un gaz inerte (un cas particulier est la première période). Chaque période contient un nombre strictement défini d'éléments. Le tableau périodique comprend huit groupes et sept périodes, la septième période n'étant pas encore terminée.
Particularité la première réside dans le fait qu'il ne contient que 2 éléments gazeux sous forme libre : l'hydrogène et l'hélium. La place de l'hydrogène dans le système est ambiguë. Comme il présente des propriétés communes avec les métaux alcalins et avec les halogènes, il est placé soit dans les sous-groupes 1a ou Vlla, soit les deux à la fois, en enfermant un symbole entre parenthèses dans l'un des sous-groupes. L'hélium est le premier représentant du sous-groupe VIIIa. Pendant longtemps, l'hélium et tous les gaz inertes ont été isolés dans un groupe zéro indépendant. Cette disposition a nécessité une révision après la synthèse des composés chimiques du krypton, du xénon et du radon. En conséquence, les gaz inertes et les éléments de l'ancien groupe VIII (fer, cobalt, nickel et platine) ont été combinés en un seul groupe.
Seconde la période contient 8 éléments. Cela commence par le lithium alcalin, dont le seul état d'oxydation est +1. Vient ensuite le béryllium (métal, degré d'oxydation +2). Le bore présente déjà un caractère métallique faiblement prononcé et est un non-métal (état d'oxydation +3). Le carbone à côté du bore est un non-métal typique qui présente à la fois des états d'oxydation +4 et -4. L'azote, l'oxygène, le fluor et le néon sont tous des non-métaux, et l'azote a l'état d'oxydation le plus élevé +5 correspondant au numéro de groupe. L'oxygène et le fluor sont parmi les non-métaux les plus actifs. Le néon à gaz inerte complète la période.
Troisième période (sodium - argon) contient également 8 éléments. La nature du changement de leurs propriétés est à bien des égards similaire à celle observée pour les éléments de la deuxième période. Mais il y a aussi une spécificité ici. Ainsi, le magnésium, contrairement au béryllium, est plus métallique, tout comme l'aluminium par rapport au bore. Le silicium, le phosphore, le soufre, le chlore, l'argon sont tous des non-métaux typiques. Et tous, à l'exception de l'argon, présentent les états d'oxydation les plus élevés égaux au numéro de groupe.
Comme vous pouvez le voir, dans les deux périodes, à mesure que Z augmente, il y a un affaiblissement distinct des propriétés métalliques et un renforcement des propriétés non métalliques des éléments. DI Mendeleev a qualifié les éléments des deuxième et troisième périodes (selon ses propres termes, petits) de typiques. Les éléments de petites périodes sont parmi les plus courants dans la nature. Le carbone, l'azote et l'oxygène (avec l'hydrogène) sont des organogènes, c'est-à-dire les principaux éléments de la matière organique.
Tous les éléments de la première à la troisième périodes sont placés dans des sous-groupes a.
Quatrième période (potassium - krypton) contient 18 éléments. Selon Mendeleev, c'est la première grande période. Le potassium de métal alcalin et le calcium de métal alcalino-terreux sont suivis d'une série d'éléments, constitués de 10 métaux dits de transition (scandium - zinc). Tous appartiennent aux sous-groupes b. La plupart des métaux de transition présentent des états d'oxydation supérieurs égaux au numéro de groupe, à l'exception du fer, du cobalt et du nickel. Les éléments allant du gallium au krypton appartiennent aux sous-groupes a. Un certain nombre de composés chimiques sont connus pour le krypton.
Cinquième la période (rubidium - xénon) est de structure similaire à la quatrième. Il contient également un insert de 10 métaux de transition (yttrium-cadmium). Les éléments de cette période ont leurs propres caractéristiques. Dans la triade ruthénium - rhodium - palladium, pour le ruthénium, on connaît des composés où il présente un état d'oxydation de +8. Tous les éléments des sous-groupes a ‑ présentent les états d'oxydation les plus élevés égaux au numéro de groupe. Les caractéristiques du changement des propriétés des éléments des quatrième et cinquième périodes à mesure que Z grandit sont plus complexes en comparaison avec les deuxième et troisième périodes.
Sixième la période (césium - radon) comprend 32 éléments. Au cours de cette période, en plus de 10 métaux de transition (lanthane, hafnium - mercure), il existe également un ensemble de 14 lanthanides - du cérium au lutétium. Les éléments allant du cérium au lutétium sont chimiquement très similaires et, pour cette raison, ils ont longtemps été inclus dans la famille des éléments des terres rares. Dans la forme abrégée du tableau périodique, un certain nombre de lanthanides sont inclus dans la cellule du lanthane et le décodage de cette série est donné au bas du tableau (voir. Lanthanides).
Quelle est la spécificité des éléments de la sixième période ? Dans la triade osmium - iridium - platine, l'état d'oxydation +8 est connu pour l'osmium. L'astate a un caractère métallique assez prononcé. Le radon est le plus réactif de tous les gaz inertes. Malheureusement, en raison du fait qu'il est hautement radioactif, sa chimie est mal comprise (voir Éléments radioactifs).
Septième la période commence à partir de la France. Comme le sixième, il devrait également contenir 32 éléments, mais 24 d'entre eux sont encore connus.Le francium et le radium sont respectivement des éléments des sous-groupes Ia et IIa, les anémones appartiennent au sous-groupe IIIb. Elle est suivie par la famille des actinides, qui comprend des éléments allant du thorium au lawrentium et se situe de la même manière que les lanthanides. Une explication de cette rangée d'éléments est également donnée en bas du tableau.
Voyons maintenant comment les propriétés des éléments chimiques changent dans sous-groupes le système périodique. La régularité principale de ce changement réside dans le renforcement du caractère métallique des éléments avec la croissance de Z. Cette régularité se manifeste particulièrement clairement dans les sous-groupes IIIa – VIIa. Pour les métaux des sous-groupes Ia – IIIa ‑, une augmentation de l'activité chimique est observée. Dans les sous-groupes des éléments IVa – VIIa ‑, à mesure que Z augmente, un affaiblissement de l'activité chimique des éléments est observé. Pour les éléments des sous-groupes b, la nature du changement d'activité chimique est plus complexe.
La théorie du système périodique a été développée par N. Bohr et d'autres scientifiques dans les années 1920. XXe siècle et est basé sur schéma réel la formation de configurations électroniques d'atomes (voir. Atom). Selon cette théorie, à mesure que Z augmente, le remplissage des couches et sous-couches d'électrons dans les atomes des éléments inclus dans les périodes du tableau périodique se produit dans la séquence suivante :
| Numéros de période | ||||||
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 1s | 2s2p | 3s3p | 4s3d4p | 5s4d5p | 6s4f5d6p | 7s5f6d7p |
Sur la base de la théorie du système périodique, la définition suivante d'une période peut être donnée : une période est un ensemble d'éléments qui commence par un élément avec une valeur n égale au numéro de période et l = 0 (s - éléments) et se termine par un élément de même valeur n et l = 1 (p - éléments) (voir Atom). L'exception est la première période ne contenant que des éléments 1s. De la théorie du système périodique, les nombres d'éléments dans les périodes suivent : 2, 8, 8, 18, 18, 32 ...
Dans le tableau, les symboles de chaque type d'élément (éléments s, p, d et f) sont représentés sur un certain fond de couleur : éléments s - sur rouge, éléments p - sur orange, éléments d - sur bleu, éléments f - sur vert. Chaque cellule contient les numéros de série et les masses atomiques des éléments, ainsi que les configurations électroniques des couches électroniques externes.
De la théorie du tableau périodique, il s'ensuit que les sous-groupes a comprennent des éléments avec n égal au nombre de la période, et l = 0 et 1. Les sous-groupes b comprennent les éléments dans les atomes desquels les coquilles sont terminées, qui ont été incomplet auparavant. C'est pourquoi les première, deuxième et troisième périodes ne contiennent pas d'éléments de sous-groupes b.
La structure du tableau périodique des éléments est étroitement liée à la structure des atomes des éléments chimiques. Au fur et à mesure que Z grandit, des types similaires de configurations des couches électroniques externes se répètent périodiquement. À savoir, ils déterminent les principales caractéristiques du comportement chimique des éléments. Ces caractéristiques se manifestent de différentes manières pour les éléments des sous-groupes a (éléments s et p), pour les éléments des sous-groupes b (éléments de transition d) et les éléments des familles f - lanthanides et actinides. Les éléments de la première période - hydrogène et hélium - représentent un cas particulier. L'hydrogène est très réactif car son seul électron 1s est facilement scindé. Dans le même temps, la configuration de l'hélium (1s 2) est très stable, ce qui détermine son inactivité chimique.
Pour les éléments des sous-groupes a, les couches électroniques externes des atomes sont remplies (avec n égal au nombre de la période), par conséquent, les propriétés de ces éléments changent sensiblement à mesure que Z augmente. Ainsi, dans la deuxième période, le lithium (configuration 2s) est un métal actif qui perd facilement un seul électron de valence ; Le béryllium (2s 2) est également un métal, mais moins actif du fait que ses électrons externes sont plus fermement liés au noyau. De plus, le bore (2s 2 p) a un caractère métallique faiblement exprimé, et tous les éléments ultérieurs de la deuxième période, dans lesquels se produit la construction d'une sous-couche 2p, sont déjà des non-métaux. La configuration à huit électrons de la couche externe d'électrons du néon (2s 2 p 6) - un gaz inerte - est très forte.
Les propriétés chimiques des éléments de la deuxième période s'expliquent par la tendance de leurs atomes à acquérir la configuration électronique du gaz inerte le plus proche (la configuration de l'hélium - pour les éléments du lithium au carbone ou la configuration du néon - pour les éléments du carbone au fluor). C'est pourquoi, par exemple, l'oxygène ne peut pas présenter l'état d'oxydation le plus élevé égal au numéro de groupe : après tout, il lui est plus facile de réaliser la configuration du néon en acquérant des électrons supplémentaires. La même nature du changement de propriétés se manifeste dans les éléments de la troisième période et dans les éléments s et p de toutes les périodes suivantes. Dans le même temps, l'affaiblissement de la force de liaison des électrons externes avec le noyau dans les sous-groupes a à mesure que Z grandit se manifeste dans les propriétés des éléments correspondants. Ainsi, pour les éléments s, il y a une augmentation notable de l'activité chimique à mesure que Z augmente, et pour les éléments p, une augmentation des propriétés métalliques est observée.
Dans les atomes des éléments d de transition, les coquilles non terminées plus tôt sont complétées par la valeur du nombre quantique principal n, un de moins que le nombre de période. À quelques exceptions près, la configuration des couches électroniques externes des atomes d'éléments de transition est ns 2. Par conséquent, tous les éléments d sont des métaux, et c'est pourquoi les changements dans les propriétés des éléments d avec l'augmentation de Z ne sont pas aussi marqués que ceux observés dans les éléments s et p. Dans les états d'oxydation supérieurs, les éléments d présentent une certaine similitude avec les éléments p des groupes correspondants du tableau périodique.
Les particularités des propriétés des éléments des triades (sous-groupe VIIIb) s'expliquent par le fait que les sous-couches b sont presque terminées. C'est pourquoi les métaux fer, cobalt, nickel et platine ont tendance à être réticents à donner des composés dans des états d'oxydation plus élevés. Les seules exceptions sont le ruthénium et l'osmium, qui donnent les oxydes RuO 4 et OsO 4. Pour les éléments Ib- et IIb - sous-groupes, la sous-couche d - est en fait complétée. Par conséquent, ils présentent des états d'oxydation égaux au numéro de groupe.
Dans les atomes de lanthanides et d'actinides (tous des métaux), l'achèvement des couches d'électrons auparavant incomplètes avec la valeur du nombre quantique principal n est inférieur de deux unités au nombre de période. Dans les atomes de ces éléments, la configuration de la couche électronique externe (ns 2) reste inchangée et la troisième couche externe N ‑ est remplie d'électrons 4f . C'est pourquoi les lanthanides sont si similaires.
Pour les actinides, la situation est plus compliquée. Dans les atomes d'éléments avec Z = 90-95, les électrons 6d et 5f peuvent participer à des interactions chimiques. Par conséquent, les actinides ont beaucoup plus d'états d'oxydation. Par exemple, pour le neptunium, le plutonium et l'américium, on connaît des composés dans lesquels ces éléments agissent à l'état heptavalent. Seulement dans les éléments, à commencer par le curium (Z = 96), l'état trivalent devient stable, mais là aussi, il y a quelques particularités. Ainsi, les propriétés des actinides diffèrent significativement de celles des lanthanides, et donc les deux familles ne peuvent pas être considérées comme similaires.
La famille des actinides se termine par un élément avec Z = 103 (lawrencia). L'évaluation des propriétés chimiques du kurchatovium (Z = 104) et du nielsborium (Z = 105) montre que ces éléments devraient être analogues à l'hafnium et au tantale, respectivement. Par conséquent, les scientifiques pensent qu'après la famille des actinides dans les atomes, un remplissage systématique de la sous-couche 6d commence. L'évaluation de la nature chimique des éléments avec Z = 106-110 n'a pas été réalisée expérimentalement.
Le nombre fini d'éléments que couvre le système périodique est inconnu. Le problème de sa borne supérieure est peut-être le principal mystère du tableau périodique. L'élément le plus lourd que l'on trouve dans la nature est le plutonium (Z = 94). La limite atteinte de la fusion nucléaire artificielle est un élément de numéro atomique 110. La question demeure : sera-t-il possible d'obtenir des éléments avec de grands numéros de série, lesquels et combien ? On ne peut pas encore y répondre de manière définitive.
A l'aide des calculs les plus complexes effectués sur des machines informatiques, les scientifiques ont tenté de déterminer la structure des atomes et d'évaluer les propriétés les plus importantes des "superéléments", jusqu'à d'énormes numéros de série (Z = 172 et même Z = 184). Les résultats obtenus étaient assez inattendus. Par exemple, dans un atome d'un élément avec Z = 121, l'apparence d'un électron 8p est supposée ; c'est après que la formation de la sous-couche 8s a été achevée dans les atomes avec Z = 119 et 120. Mais l'apparition d'électrons p après les électrons s n'est observée que dans les atomes des éléments des deuxième et troisième périodes. Les calculs montrent également que dans les éléments de la huitième période hypothétique, le remplissage des couches d'électrons et des sous-couches d'atomes se produit dans une séquence très complexe et particulière. Par conséquent, l'évaluation des propriétés des éléments correspondants est un problème très difficile. Il semblerait que la huitième période devrait contenir 50 éléments (Z = 119-168), mais, selon les calculs, elle devrait se terminer à l'élément avec Z = 164, soit 4 numéros de série plus tôt. Et il s'avère que la neuvième période "exotique" devrait comprendre 8 éléments. Voici son record « électronique » : 9s 2 8p 4 9p 2. Autrement dit, il ne contiendrait que 8 éléments, comme les deuxième et troisième périodes.
Il est difficile de dire à quel point les calculs effectués à l'aide d'un ordinateur correspondraient à la vérité. Cependant, si elles étaient confirmées, il serait alors nécessaire de réviser sérieusement les lois qui sous-tendent le tableau périodique des éléments et sa structure.
Le tableau périodique a joué et continue de jouer un rôle énorme dans le développement de divers domaines des sciences naturelles. Elle est venue succès majeur doctrine atomique-moléculaire, a contribué à l'émergence du concept moderne d'« élément chimique » et à la clarification des concepts de substances et de composés simples.
Les régularités révélées par le système périodique ont eu un impact significatif sur le développement de la théorie de la structure des atomes, la découverte des isotopes et l'émergence d'idées sur la périodicité nucléaire. Une formulation strictement scientifique du problème de la prévision en chimie est liée au système périodique. Cela s'est manifesté par la prédiction de l'existence et des propriétés d'éléments inconnus et de nouvelles caractéristiques du comportement chimique d'éléments déjà découverts. Aujourd'hui, le système périodique est le fondement de la chimie, principalement inorganique, aidant de manière significative à résoudre le problème de la synthèse chimique de substances aux propriétés prédéterminées, le développement de nouveaux matériaux semi-conducteurs, la sélection de catalyseurs spécifiques pour divers processus chimiques, etc. Et enfin , le système périodique est la base de l'enseignement de la chimie.
